Уравнения качественных реакций
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин

В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
- I группа
II группа
Be, Zn, Al
Медь
Серебро
Железо
Хром
Марганец
Ртуть
Ион аммония
Водород
Галогены: F, Cl, Br, I
Сера
Карбонат — ион
Фосфат — ион
Силикат — ион
Оксид азота (IV) — ион
Гидроксид-ион
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li+
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
3LiCl + Na3PO4 → Li3PO4↓ + 3NaCl
Сокращенное ионное уравнение:
3Li++ PO43- → Li3PO4↓
2) Na+
Окрашивает пламя горелки в желтый цвет.
3) K+
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb+
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs+
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca2+
Образует белый осадок с карбонат-ионом: CaCl2 + K2CO3 → CaCO3↓ + 2KCl
Сокращенное ионное уравнение: Ca2+ + CO32- → CaCO3↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Катион кальция окрашивает пламя горелки в оранжево-красный цвет.
2. Sr2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом:SrCl2 + K2SO4 → SrSO4↓ + 2KCl
Сокращенное ионное уравнение:Sr2+ + SO42- → SrSO4↓
Окрашивает пламя горелки в темно-красный цвет.
3. Ba2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом: BaCl2 + K2SO4 → BaSO4↓ + 2KCl
Сокращенное ионное уравнение: Ba2+ + SO42- → BaSO4↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg2+
Определяется, как и кальций, карбонат-ионами.
Карбонат магния – белый осадок: Mg(NO3)2 + K2CO3 → MgCO3↓ + 2KNO3
Сокращенное ионное уравнение: Mg2+ + CO32- → MgCO3↓
III. Be0 (Be2+), Zn0 (Zn2+), Al0 (Al3+)
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в растворе щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…», то имеют в виду один из этих трех металлов.
Реакции:
Be + 2KOH + 2H2O → K2[Be(OH)4] + H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl2 + 2KOH → Be(OH)2↓ + 2KCl
(образование осадка)сокращенное ионное уравнение:
Be2+ + 2OH— → Be(OH)2↓Be(OH)2 + 2KOH → K2[Be(OH)4] (растворение осадка)
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KCl (образование осадка)
сокращенное ионное уравнение: Zn2+ + 2OH— → Zn (OH)2↓
Zn(OH)2 + 2KOH → K2[Zn(OH)4] (растворение осадка)
AlCl3 + 3KOH → Al(OH)3↓ + 3KOH (образование осадка)
сокращенное ионное уравнение:
Al3+ + 3OH— → Al(OH)3↓
Al(OH)3 + KOH → K[Al(OH)4] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4]
У гидроксида цинка есть характерная особенность: он растворяется в NH3 (водн.)
Zn(OH)2 + 4NH3*H2O → [Zn(NH3)4](OH)2 + 4H2O
Ион Zn2+ с S2+ образует белый осадок. Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO4 + K2S → ZnS↓ + K2SO4 (образование осадка)
Сокращенное ионное уравнение:
Zn2+ + S2- → ZnS↓
ZnS + H2SO4 → ZnSO4 + H2S↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Cu + 2H2SO4(конц.) → CuSO4 + SO2↑ + 2H2O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl2 + H2O
Cu2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску, это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl
Сокращенное ионное уравнение:
Cu2+ + 2OH— → Cu(OH)2↓
растворение осадка в кислотах: Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Осадок Cu(OH)2 растворяется в избытке NH3(водн.) образуя интенсивно синий раствор:
Cu(OH)2 + 4NH3*H2O → [Cu(NH3)4](OH)2 + 4H2O
Если нагреть осадок Cu(OH)2, то он почернеет. Потому что гидроксид меди(II) – нерастворимое основание и разлагается:
Cu(OH)2 (t)→ CuO (черный) + H2O
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag2O- черный – основный.
Ag+
Катион серебра с хлорид-ионом дает белый творожистый осадок: AgNO3 + KCl → AgCl↓ + KNO3
сокращенное ионное уравнение: Ag+ + Cl— → AgCl↓
Осадок хлорида серебра (и остальные галогениды), как и гидроксида меди, растворяется в NH3*H2O
AgCl + 2NH3*H2O → [Ag(NH3)2]Cl + 2H2O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи, выпадает черный осадок оксида серебра:
AgNO3 + KOH → KNO3 + AgOH
2AgOH → Ag2O↓ + H2O
можно (и грамотнее) записать сразу:
2AgNO3 + 2KOH → Ag2O↓ + H2O + 2KNO3
То есть при добавлении к соли серебра щелочи выпадает черный осадок.Осадок оксида серебра, как и галогениды этого металла, растворяются в NH3(водн.):
Ag2O + 4NH3*H2O → 2[Ag(NH3)2]OH + 3Н2O
[Ag(NH3)2]OH – гидроксид диамминсеребра(I) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Ag2O + 2HNO3 → 2AgNO3 + H2O
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2HCl + Fe → FeCl2 + H2↑
И сравните с:
2Fe + 3Cl2 (t)→ 2FeCl3
Катион Fe3+
определяется гидроксид-ионом.
При добавлении к раствору, содержащему ионы трехвалентного железа, выпадает бурый осадок гидроксида железа (III):
Fe2(SO4)3 + 6KOH → 2Fe(OH)3↓ + 3K2SO4
Сокращенное ионное уравнение:
Fe3+ + 3OH— → Fe(OH)3↓
Оксид и гидроксид железа(III) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Fe2O3 + 2KOH + 3H2O → 2K[Fe(OH)4]
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Fe(OH)3 + KOH → K[Fe(OH)4]
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Катион Fe2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета.
FeSO4 + 2KOH → Fe(OH)2↓ + 3K2SO4
Сокращенное ионное уравнение: Fe2+ + 2OH— → Fe(OH)2↓
Оксид и гидроксид железа(II) – основные.
В щелочах не растворяются.Осадок со временем буреет (меняет степень окисления с 2+ на +3):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe2+ + 3[FeIII(CN)6]3− → FeIII4[FeII(CN)6]3↓
Ион Fe3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe3+ + 3[FeII(CN)6]4− → FeIII4[FeII(CN)6]3↓
Хром – блестящий белый металл.
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + 2HCl → CrCl2 + H2↑
Cr + H2SO4(разб.) → CrSO4 + H2↑
Cr + S (t)→ CrSC окислителями приобретает степень окисления +3:
2Cr + 3Cl2 (t)→ 2CrCl3
4Cr + 3O2 (t)→ 2Cr2O3
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
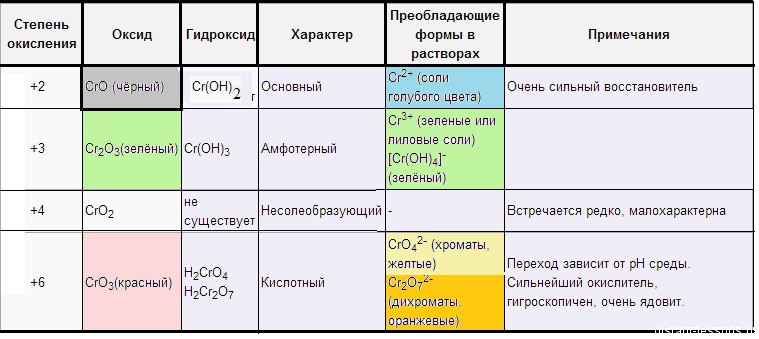
Оксид хрома (II) – CrO(основный) – черный.
Растворы солей Cr2+ голубые. Если обработать черный оксид хрома(II) соляной кислотой, образуется голубой раствор:
CrO + 2HCl → CrCl2 + H2O
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома(II), (осадок на воздухе зеленеет, об этом чуть позже):
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Сокращенное ионное уравнение:
Cr2+ + 2OH— → Cr(OH)2↓
Гидроксид хрома(II) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Степень окисления +3.
Оксид хрома(III) – Cr2O3 (амфотерный) – зеленый.
Как амфотерный оксид Cr2O3 растворяется в кислотах и щелочах:
Cr2O3
+ 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2KOH + 3H2O → 2K[Cr(OH)4]
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr3+ в растворе определяется добавлением щелочи.
Cr3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома(III):
Cr(NO3)3 + 3NaOH → Cr(OH)3↓ + 3NaNO3
Сокращенное ионное уравнение:
Cr3+ + 3OH— → Cr(OH)3↓
Выпавший осадок – гидроксид хрома(III) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH → K[Cr(OH)4]
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома(II), то он позеленеет. Cr+2 окисляется до Cr+3,
образуется зеленый гидроксид хрома(III):
4Cr(OH)2 + 2H2O + O2 → 4Cr(OH)3
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
2Na[Cr(OH)4] + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 8H2O
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома(VI) – CrO3 (кислотный) – красный.
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI] в спиртах (альдегидах, эфирах)»
3H3C–CH2–OH + 4CrO3 + 6H2SO4 → 3H3C–COOH + 2Cr2(SO4)3 + 9H2O
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
2KOH + CrO3 → K2CrO4 + H2O
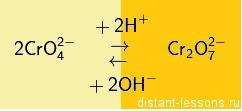
Хроматы – это соли хромовой кислоты (H2CrO4). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту (H2Cr2O7), ее соли – бихроматы (дихроматы) оранжевые.
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
Качеcтвенная реакция на хромат-ион(CrO42-).
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO4:
K2CrO4 + Ba(NO3)2 → 2KNO3 + BaCrO4↓
Сокращенное ионное уравнение: Ва2+ + СrO42- → BaCrO4↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2BaCrO4 + 2H+ → 2Ba2+ + Cr2O72- + H2O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Марганец – серебристо-белый металл.
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Mn + O2 (t)→ MnO2
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца(II) – MnO (основный) зеленого цвета.
На воздухе очень быстро окисляется до темно-бурого MnO2:
2MnO + O2 → 2MnO2
Соли, содержащие катион Mn2+ как правило имеют бледный светло-розовый цвет.
Катион Mn2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца(II), который окисляется на воздухе и буреет (превращается в бурый оксид марганца(II)):
MnCl2 + 2KOH → Mn(OH)2↓ + 2KCl
Сокращенное ионное уравнение:
Mn2+ + 2OH— → Mn(OH)2↓
Осадок буреет:
2Mn(OH)2 + O2 → 2MnO2 + 2H2O
Степень окисления 4+.Оксид марганца(IV) – MnO2 (амфотерный) темно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Сильный окислитель:
Mn+4O2 + 4HCl → Mn+2Cl2 + Cl2↑ + 2H2O
Степень окисления +6. Оксид марганца(VII) – Mn2O7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца(VII) соответствует марганцевая кислота HMnO4.
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску.
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
3CH2=CH2 + 2KMnO4 + 4H2O → 3HOH2C—CH2OH + 2MnO2↓ + 2KOH
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg2+: при добавлении к раствору соли ртути(II) щелочи выпадает оранжевый осадок ОКСИДА ртути, гидроксид не образуется, его не существует:
Hg(NO3)2 + 2KOH → HgO + H2O + 2KNO3
Подробнее в статье: //distant-lessons.ru/soedineniya-rtuti.html
NH4+ – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. Выделяется аммиак – газ с реким запахом (запах нашатырного спирта):
NH4NO3 + KOH → NH4OH + KNO3
HN4OH → NH3↑ + H2O
Можно записать сразу: NH4NO3 + KOH → NH3↑ + H2O + KNO3
Сокращенное ионное уравнение: NH4+ + NO3— → NH3↑ + H2O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония:NH3 + HCl → NH4Cl
H+
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H3O+.
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый, метиловый оранжевый, фенолфталеин.
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
лакмус – фиолетовый,
метиловый оранжевый – оранжевый,
фенолфталеин – бесцветный.
| Индикатор | Цвет в кислой средеpH < 7 | Цвет в нейтральной средеpH = 7< | Цвет в щелочной средеpH > 7 |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
-
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
-
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
-
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA-группы(F,Cl,Br,I), типичные неметаллы.
Пойдем по порядку:
-
Фтор – F2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы (F—) в растворе определяются добавлением катионов кальция (Ca2+), наблюдается выпадение белого осадка:
2KF + CaCl2 → 2KCl + CaF2↓
Сокращенное ионное уравнение: Ca2+ + 2F— → CaF2↓
- Хлор – Cl2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы (Cl—) в растворе определяются добавлением катионов серебра (Ag+), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO3 → AgCl↓ + KNO3
Сокращенное ионное уравнение: Ag+ + Cl— → AgCl↓
- Бром – Br2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы (Br—) в растворе определяются добавлением катионов серебра (Ag+), наблюдается выпадение слегка желтоватого осадка:
KBr+ AgNO3 → AgBr↓ + KNO3
Сокращенное ионное уравнение: Ag+ + Br— → AgBr↓
- Иод – I2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы (I—) в растворе определяются добавлением катионов серебра (Ag+), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра):
KI + AgNO3 → AgI↓ + KNO3
Сокращенное ионное уравнение: Ag+ + I— → AgI↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе (S2-) и гидросульфИД-ионе (HS—).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H2S – сероводород, газ с неприятным запахом тухлых яиц:
K2S + 2HCl → 2KCl + H2S↑
Сокращенное ионное уравнение: 2H+ + S2- → H2S↑
Выделившийся газ (H2S) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
2H2S + 3O2 (t)→ 2SO2 + 2H2O
Так же сероводород (H2S) может быть поглощен растворами щелочей:H2S + 2NaOH →
Na2S + 2H2O
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+. Образуется черный осадок сульфида серы:
Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3
- С ионами Cu2+, Fe2+, Ni2+, Cu2+, Pb2+, Hg2+, Ag+ и ионами многих других металлов тоже образуются осадки черного цвета.
- С ионом Zn2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Zn(NO3)2 + Na2S → ZnS↓ + 2NaNO3
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода…». Речь идет о
черном осадке сульфида свинца (PbS). Пероксид водорода H2O2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца (PbSO4):
PbS(черн.) + 4H2O2 → PbSO4(бел.) + 4H2O
Степень окисления +4:
встречается в оксиде серы (IV) (сернистом газе – SO2), в соответствующей этому оксиду кислоте – сернистой (H2SO3, существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ (SO2) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: «обесцвечивает раствор фуксина и фиолетовые чернила», при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…»). Образуются соли сернистой кислоты – сульфиты:
2NaOH + SO2 → Na2SO3 + H2O
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H2SO3, которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид (SO2). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
K2SO3 + 2HCl → 2KCl + H2SO3H2SO3 → H2O + SO2↑
Можно (и грамотнее) записать сразу:
K2SO3 + 2HCl → 2KCl + SO2↑ + H2O
Степень окисления +6
встречается в серном ангидриде (оксиде серы(VI) – SO3), в соответствующей ему серной кислоте (H2SO4) и в ее солях, сульфАТах.
Серный ангидрид (SO3) и серная кислота(H2SO4) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария (Ba2+). Сульфат-ион с катионом бария образует белый осадок (нерастворимый в кислотах):
Ba(NO3)2 + K2SO4 → BaSO4↓ + 2HNO3
Сокращенное ионное уравнение: Ва2+ + SO42- → BaSO4↓
CO32-
– карбонат-ион и HCO3— – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха:
K2CO3 + 2HCl → 2KCl + H2CO3H2CO3 → CO2↑ + H2O
Можно (и грамотнее) записать сразу: K2CO3 + 2HCl → 2KCl + CO2↑ + H2O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO2 не поддерживает горения:
H3C–COOH + NaHCO3 → H3C – COONa + CO2↑ + H2O
Выделившийся углекислый газ может быть поглощен раствором щелочи:
CO2 + 2NaOH → Na2CO3 + H2O
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение…». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
PO43-
– фосфат—ион
– анион ортофосфорной кислоты (H3PO4). В растворе его можно определить добавлением катионов серебра, при этом выпадает интенсивно-желтый осадок:
3AgNO3 + K3PO4 → Ag3PO4↓ + 3KNO3
Сокращенное ионное уравнение: 3Ag+ + PO43- → Ag3PO4↓
SiO32-
– силикат-ион
– анион кремниевой кислоты (H2SiO3), которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H2SiO3:
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl
2H+ + SiO32- → H2SiO3↓
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
K2SiO4 + H2CO3 → H2SiO3↓ + K2CO3
– оксид азота (VI).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ.
Химически очень активное вещество:
Образуется:
- при взаимодействии не очень активных металлов с HNO3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
2NO2 + H2O → HNO3 + HNO2
Похожая реакция диспропорционирования происходит при растворении NO2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
2NO2 + 2KOH → KNO2 + KNO3 + H2O
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
4NO2 + 2H2O + O2 → 4HNO3
OH—
Наличие в растворе ионов OH— указывает на щелочную реакцию среды (pH>7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H+. Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
.
































Добрый день. Скажите пожалуйста,как определить монофторофосфат и лаурисульфат натрия. Сапсибо за ответ.
Влад
монофторофосфат — сначала гидролиз, затем определяют содержание образующегося фторида или фосфата. Правда, эти ионы мшают друг другу, так что, думаю, только хроматографией.
лаурисульфат натрия — не знаю в плане реакимва. Можно по цвету — цвет водного раствора лаурилсульфата натрия от жёлтого до желто-коричневого. В водных растворах образует стойкую пену.
Здравствуйте! Скажите пожалуйста,а в ОГЭ эта информация нужна? И если нужна,то нужно всё учить?
в ОГЭ нужно не все так подробно. Нужны качественные реакции для углеводородов, спиртов, альдегидов и кислот
То есть выучить всё, что здесь:http://distant-lessons.ru/pervonachalnye-svedeniya-ob-organicheskix-veshhestvax.html
И всё?
да, и еще уравнения качественных реакций. Для уровня ГИА не нужно уметь писать их самим, достаточно знать, реагируют ли и как