Элемент Хром
Элемент — Хром
За счет большого количества валентных электронов образует большое количество окрашенных соединений.
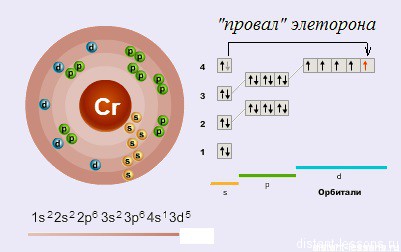
Электронное строение атома
Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:
+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:
2Сr + 3F2 = 2CrF3
4Cr + 3O2 = 2Cr2O3 - Взаимодействие с водой (при нагревании):
2Cr + 3H2O = Cr2O3 + 3H2 - Взаимодействие с кислотами
— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует
— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + H2
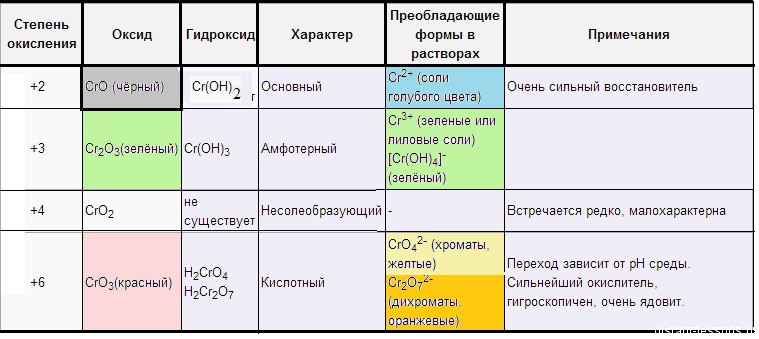
Оксиды хрома
СrO — оксид хрома (II), (черного цвета) — основной оксид.
Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(OH3).
СrO + 2HCl = CrCl2 + H2O (cоли — голубого цвета)
Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 + 2NaOH = 2NaCrO2 + H2O
Cr2O3 + 6HCl = 2CrCl3 + 3H2OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Соли Cr(3+) — зеленого цвета
СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и H2Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
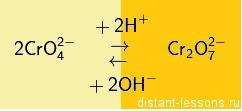
CrO4(2-) — хроматы — желтого цвета
Сr2O7(2-) — бихроматы — оранжевого цвета
В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:
Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:
Отсюда, кстати, и название элемента: «хром» — это «цвет»!
У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Здравствуйте, Лолита! Объясните, пожалуйста вот такую реакцию:
K2Cr2O7 + H2SO4 = K2SO4 + 2CrO3 + H2O.
Согласно стандартной схеме: соль + кислота = другая соль + другая кислота. Но почему в этой реакции записаны раздельно кислотный оксид и вода? Можно ли вместо них написать дихромовую кислоту (т.к. воды в недостатке)? Получается, что образование кислоты идет через образование соответствующего оксида и последующем растворении его (если растворяется) в воде?
Добрый день! Да, реакция более чем странная — было бы логично записать продукты реакции как K2SO4 и H2CrO4… А откуда эта реакция? Я такое раньше не встречала? мне кажется, это кто-то навыдумывал того, что ни в реальности, ни в ЕГЭ нет — сейчас таких выдумщиков много
Эта реакция указана как способ получения оксида хрома (VI) — действие конц. серной кислоты на твердые хроматы и дихроматы (Габриелян, Остроумов, «Пособие для школьников старших классов и поступающих в ВУЗы»).
Вот ещё одна подобная реакция оттуда же — получение оксида марганца (VII):
2KMnO4 + H2SO4 = K2SO4 + H2O + Mn2O7
Ну, вообще, такие кислоты легко разлагаются на оксиды, так что особенно при нагревании — вполне возможно…
Если просто даны реагенты и нужно написать продукты, то лучше писать соль и кислоту
Понятно, спасибо:)