Соединения меди
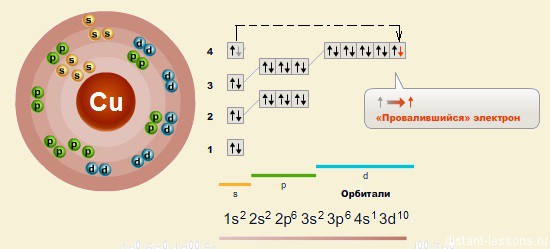
Медь относится к d-элементам.
Как и все d-элементы, соединения меди ярко окрашены.
Так же как у хрома, у меди наблюдается провал электронов — с s-орбитали на d-орбиталь
Электронное строение атома:
Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.
Простое вещество: металл золотисто-розового цвета.
Оксиды меди: Сu2O оксид меди (I) \ оксид меди 1 — красно-оранжевого цвета
СuO оксид меди (II) \ оксид меди 2 — черного цвета.
Другие соединения меди Cu(I), кроме оксида, неустойчивы.
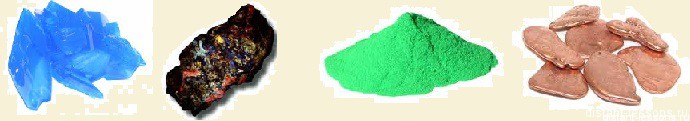
Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
 Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в ряду напряжений после водорода, поэтому не выделяет его из кислот:
- с горячей серной кислотой: Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
- с холодной серной кислотой: Сu + H2SO4 = CuO + SO2 + H2O
- с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 4NO2 + 4H2O - с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2NO +4 H2O
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
2Сu(NO3)2 → 2CuO↓ +4 NO2↑ + O2↑
Твердый осадок — оксид меди (II).
CuO + H2S → CuS↓ + H2O
Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
2СuS + 3O2 = 2CuO + 2SO2
Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
СuO + 2HNO3 = Cu(NO3)2 + H2O
CuS + 2HNO3 = Cu(NO3)2 + H2S
возможна так же другая реакция:
СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4H2O
Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + H2O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3





Почитала Ваши уроки, все понятно!