d-элементы
Эта тема часто бывает проблемной при подготовке к экзамену. Хотя она совсем не сложная.
Поэтому сначала я расскажу о «нелегкой доле российских учеников» — станет понятно, откуда «растут ноги» у этой проблемы, а потом разберем сам материал.
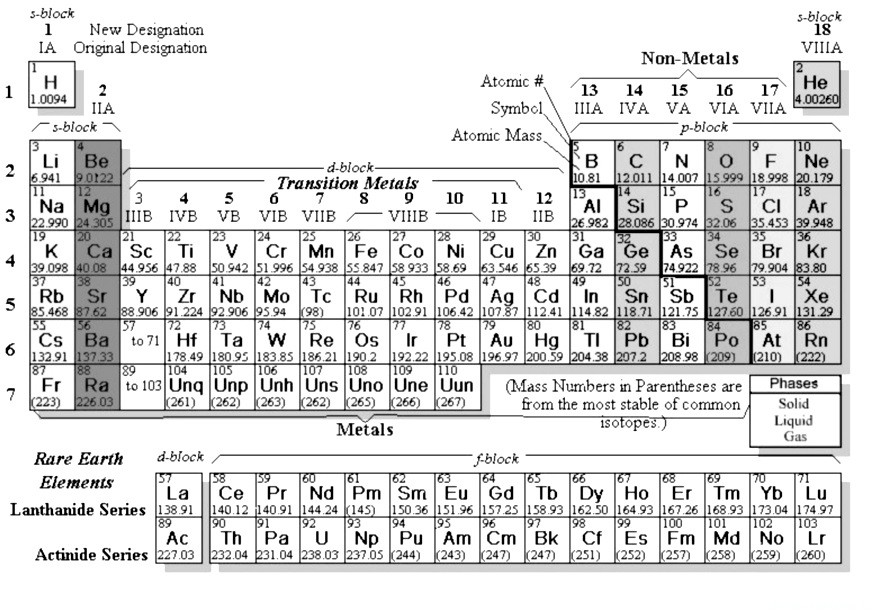
Все мы слышали об ИЮПАК (Международный союз теоретической и прикладной химии). Еще в 1989 году этот союз предложил для использования во всем мире (и весь мир согласился и до сих пор использует) так называемую «длинную форму» периодической системы элементов:
В России она почему-то не используется….
Чем же она отличается от той, которая напечатана во всех наших школьных учебниках по химии?
(На отсутствие цветов внимание не обращаем — на экзамене вам могут дать и черно-белый вариант)
- Нет подгрупп — есть только группы
- Количество групп — 18!
- d-элементы находятся между s- и p-элементами (d-block)
- соответственно, в периодах нет рядов — в них просто отпала необходимоcть
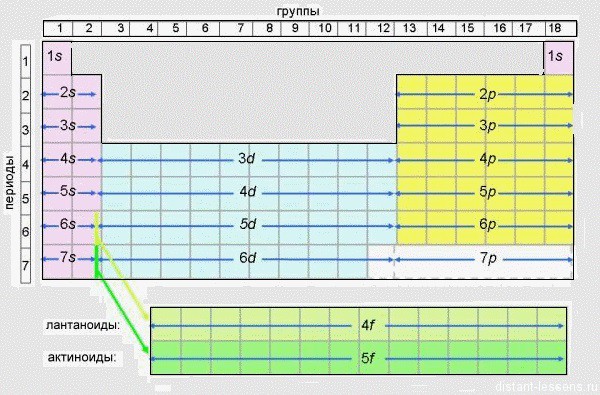
Эта таблица показывает последовательность заполнения электронами энергетических уровней.
Эту табличку я очень рекомендую распечатать и активно использовать при подготовке к экзамену. На ЕГЭ, конечно, вам дадут «короткую» форму, но к тому времени вам уже легче будет ориентироваться по ней.
Итак, со вступлением мы разобрались, перейдем непосредственно к теме…
Строение электронных оболочек атомов
d-элементов
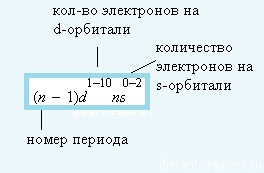
Это общая электронная формула этих элементов
Максимальное возможное количество электронов на d-подуровне — 10,
на s-подуровне — 2.
Особенности заполнения электронами подуровней:
4 период:
Обратите внимание, Sc — первый d-элемент и у него этот самый d — подуровень начинает заполняться электронами (s-подуровень уже заполнен).
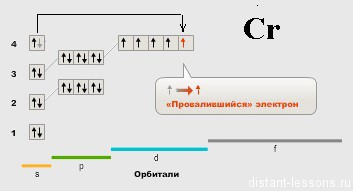
У Cr вдруг появляется «аномалия» — 1 электрон на s-подуровне.
Тут срабатывает Правило Гунда:
заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Давайте «переведем»: чем больше количество неспаренных электронов, тем лучше! 🙂
Электрон «проваливается» с S — подуровня, чтобы неспаренных электронов стало больше.
Дальше по периоду все идет нормально — планомерно заполняется электронами d-орбиталь.
У Cu и Zn d-подуровень заполняется полностью (10 электронов). Валентными будут электроны S — подуровня.
У других элементов тоже встречается такой «провал».
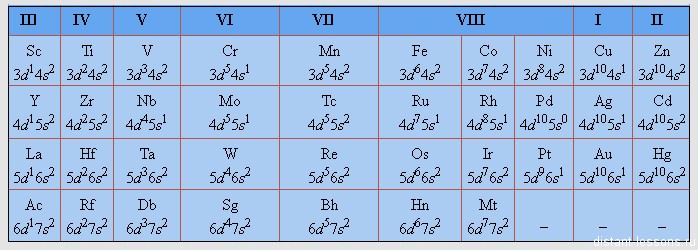
Следующие периоды мы подробно разбирать не будем, я просто приведу здесь табличку с электронными конфигурациями d-элементов.
Потренируйтесь — распишите самостоятельно строение каждого из этих элементов!
Успехов!

Известно много попыток классификации элементов по атомным массам с периодичностью октавы: Иоганн Дёберейнер(1929)У.Одлинг(1864), Дж.А.Ньюлендс(1865),Ю.Л.Мейера(1870), Д.И.Менделеев(1869)и т.д. Верное толкование химического сродства дано Дж.В.Гиббсом(1878),Я.Вант-Гоффом(1885). Конечно, в рукописи Меделеева «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»(1869)еще не было понимания октавной периодичности. Поэтому Дима не то чтобы предсказать, но даже правильно расположить не мог инертные газы.Пора остановить эту дележку заслуг,важно, что Таблица химических элементов Бора дает классификацию элементов, которая хорошо коррелирует с их свойствами.