р-элементы продолжение
Строение электронных оболочек атомов
р-элементов
по периодам
(К p-элементам относятся 30 элементов III-VIII-групп главных подгрупп периодической системы)
Мы уже рассмотрели строение электронных оболочек атомов р-элементов по группам
Давайте рассмотрим изменение электронного строения р-элементов по периодам.
- Ну, с 1-м периодом все понятно — там р-элементов нет, там всего 2 s-элемента — Н и Не.
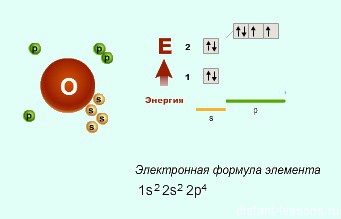
- Во втором периоде идет закономерное заполнение р-подуровня. Поэтому валентности и степени окисления не слишком разнообразные.
Если мы рассмотрим О (кислород) и F (фтор), то понятно, что для них степень окисления -2 и -1 — единственно возможные.
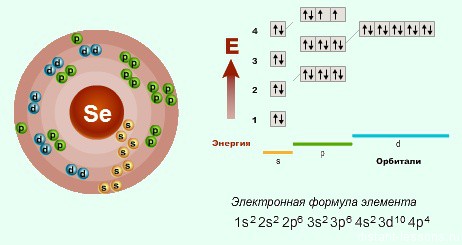
- А вот в 3-м периоде возникает небольшая особенность — появляется пока еще свободный d- подуровень. Это дает возможность атому распаривать свои электроны на р-подуровне и перебрасывать их на d-.
Именно поэтому возникает у S (серы), например, степень окисления +6 и +4, а у Cl (хлора) — +7, +5 и +3.
Если мы пойдем по периодам ниже, то там уже начинаются элементы, у которых d-подуровень полностью заполнен. Максимальное количество электронов на нем — 10.
Как видите, изменение строения электронных оболочек атомов р-элементов наблюдается не только из-за заполнения уровня электронами, но и из-за увеличения количеств самих уровней.
Обратите внимание: максимальная степень окисления p-элементов 3-го и следующих периодов равна №группы.
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие
В периодах:
- при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются,
- энергия ионизации и сродство к электрону возрастают,
- электроотрицательность увеличивается,
- окислительная активность соединений и неметаллические свойства элементов усиливаются.
В группах:
-
радиусы атомов увеличиваются,
-
от 2p-элементов к 6p-элементам энергия ионизации уменьшается,
-
с увеличением порядкового номера усиливаются металлические свойства p-элементов .