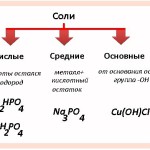
d-элементы. Задачи
d-элементы образуют очень разнообразные соединения самых разных цветов. Переход от низшей степени окисления к высшей меняет свойства соединений от основных к кислотным.
Давайте разберем задачи на d-элементы.
Первое. что нужно сделать, это записать уравнение реакции с учетом всех условий:
K2Cr2O7 + Al + H2SO4=…
Что образуется в результате? Нужно спрогнозировать продукты реакции. Дихромат калия — один из мощных окислителей, он окислит алюминий:
Al(0)-3e —> Al(3+)
В кислой среде дихромат калия восстанавливается до Cr(3+). Если мы используем метод полуреакций, то сможем предсказать все вещества:
Cr2O7(-2) + 14H(+) +6e —> 2Cr(3+) + 7H2O
Второе — уравниваем процесс окисления и процесс восстановления:
Итоговое уравнение: 2Al + K2Cr2O7 +7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Третье — объясняем изменение окраски:
Бихромат калия — соединение d-элемента Cr в высшей степени окисления. Стабильно в кислой среде и имеет желто-оранжевую (довольно яркую) окраску раствора. Как сильный окислитель, он восстанавливается в кислой среде до Cr(3+) — соли хрома в этой степени окисления окрашивают раствор в зеленый или зелено-голубоватый цвет.
Первое — записываем уравнение реакции:
Сl2 + K2MnO4 —>
Нам дано, что хлор в данной реакции является окислителем, сам восстанавливается до Cl(-).
d-элемент марганец в этом соединении проявляет степень окисления +6. Это не максимальная степень окисления для Mn, максимальная — +7. Ей соответствует вещество — перманганат калия — KMnO4.
Cl2 + 2e = 2Cl(-)
MnO4(-2) -1e =MnO4(-)
Второе — уравниваем процессы окисления и восстановления:
Сl2 +2K2MnO4 = 2KCl + 2KMnO4
Третье — определяем изменения окраски:
K2MnO4 -раствор зеленого цвета,
KMnO4 — раствор сиренево-малинового цвета.
Когда то «маргановку» — KMnO4 -марганцовокислый калий — продавали во всех аптеках.
Почти черные кристаллы, при растворении в воде образующие ярко окрашенный раствор малинового цвета.
Разбавленный раствор «марганцовки» использовали как антисептик, при ожогах и отравлениях. Сейчас в аптеках это средство не купить… 🙁
Все задачи на d-элементы сводятся к определению окислительно-восстановительных процессов и изменениям цветов растворов или осадков.
Чаще всего задачи такого рода встречаются в части С ЕГЭ. Это будет либо задание С2 — нововведение этого года — аналитическая задача, либо С1 — окислительно-восстановительные реакции, где будет указан один из продуктов, а остальные надо будет предсказать.