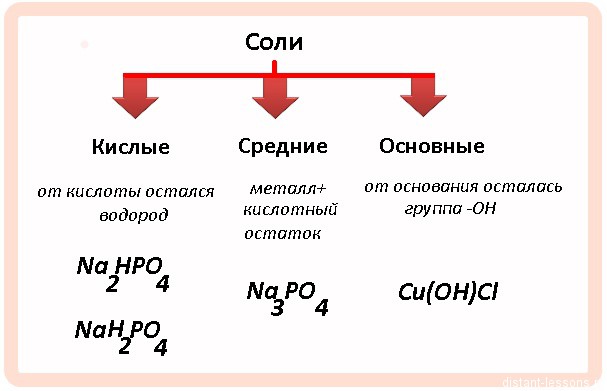
Кислые и средние соли
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=m\Mr и т=V\V м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω \Mr = 200 г*0.04 \40 г\моль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.



В последнем уравнении реакции взаимодействия гидроксида натрия и оксида серы (VI) получается гидросульфАт серы. Почему получается кислая соль?
Да, вы правы, там должен быть сульфАт — опечатку исправили, а кислая соль, т.к. NaOH недостаточно для образования средней соли
Работа изумительная. Всё достаточно просто и доступно, спасибо за пояснения!
Желаю больше таких работ по химии
Спасибо! Очень приятно! 🙂