Ионный тип связи
Мы рассмотрели 2 типа химической связи — металлическую и ковалентную (полярную и неполярную).
Давайте рассмотрим
ионный тип связи
— это очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел.
Разберем все утверждения из этого определения на примере соли NaCl
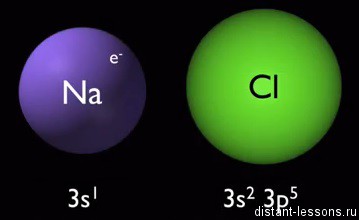
Na и Cl — элементы третьего периода Периодической системы элементов, но существенно отличаются по электронному строению.
Na — элемент 1-й группы главной подгруппы (щелочной металл), имеет на внешнем электронном уровне 1 электрон: 3S1.
Натрий — типичный представитель металлов — чтобы достигнуть стабильного состояния (8 электронов) на внешнем слое, ему нужно либо прибавить 7 электронов, либо отдать один.
А это означает, что он легко отдает этот один электрон, превращаясь в ион металла:
Na0 -1e— = Na+
Хлор — типичный представитель неметаллов — его радиус меньше, чем у атома натрия, при этом электронов больше — 3S23p5. Эти электроны довольно сильно притягиваются к ядру и до завершенной стабильной оболочки не хватает всего 1 электрона. Надо его отобрать:
Cl0 +1e— = Cl—
Образуется ион хлора.
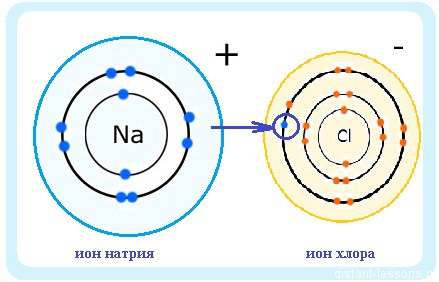
Получается, что молекула NaCl образована двумя ионами (положительным и отрицательным), притянувшимися друг у другу.
Но ведь мы точно так же рассматривали образование молекулы HCl, только говорили, что эта связь ковалентная… В чем же отличие?
Электроотрицательность атомов
— это свойство атомов, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
В молекуле NaCl образовавшаяся электронная пара смещена к атому хлора. Электроотрицательность атома хлора значительно больше электроотрицательности натрия.
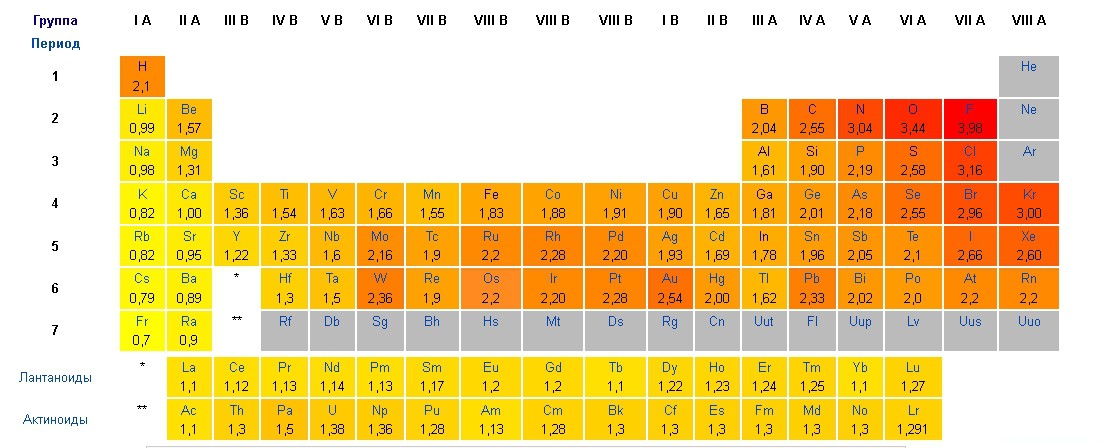
Давайте посмотрим в таблицу электроотрицательности атомов Полинга:
У натрия значение электроотрицательности — 0.98, а у хлор — 3.16 — почти в три раза больше.
Сравним с HCl — у водорода 2.1, у хлора- 3.16 — значения отличаются, но не сильно.
Т.е. в ионном типе связи существенно отличаются электроотрицательности атомов, и, как следствие, образующаяся электронная пара смещается к наиболее электроотрицательному элементу:
Свойства ионного типа связи:
- прочная химическая связь;
- высокие температуры плавления и кипения;
- вещества с ионным типом связи хорошо растворяются в полярных растворителях (это последнее свойство заметно отличает ионную связь от металлической);