Металлическая химическая связь
Вы когда-нибудь задумывались — существует ли в природе отдельный атом металла?
Металл всегда существует в виде кристалла. Естественно, это обусловлено определенным строением и предполагает определенные физические и химические свойства.
Давайте представим, что у нас есть кусок какого-то металла. Например, нам дано железо (Fe). Из чего состоит этот кусок железа?
Он состоит из атомов железа, которые находятся в строго определенном порядке — в узлах кристаллической решетки.
У атома железа, как у любого металла, на последнем электронном слое небольшое число электронов, плюс к этому, большой радиус атома. На этом последнем слое электроны держатся достаточно слабо.
Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
На примере железа:
Fe0 -2e— = Fe2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке:
Fe2+ +2e— = Fe0
Ион становится нейтральным атомом.
И такой процесс повторяется много раз.
Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
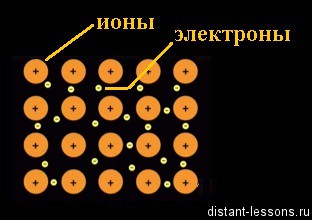
Металлическая химическая связь
Это жестко зафиксированные в узлах кристаллической решетки ионы металла и свободно перемещающиеся по всему объему кристалла электроны.
В чем-то металлическая химическая связь похожа на ионную — в ней тоже присутствуют ионы (катионы), однако, существенное отличие в том, что:
- в ионной связи есть катионы (положительно заряженные частицы) и анионы (отрицательно заряженные ионы);
- в металлической химической связи есть катионы и электроны.
Кое в чем металлическая химическая связь похожа и на ковалентную — в ней тоже есть общие электроны, но:
- в ковалентной химической связи электроны принадлежат двум элементам (локализованы между ними);
- в металлической — они принадлежат абсолютно всем ионам.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
Физические свойства металлической химической связи:
- теплопроводность (перенос теплоты частицами — в данном случае — электронами);
- электропроводность;
- все вещества — твердые (кроме некоторых щелочных металлов);
- высокие температуры плавления и кипения;
- характерный металлический блеск — он появляется за счет отражения лучей электронами; если металл растереть до порошкообразного состояния, металлический блеск пропадает — нет кристаллической решетки — нет свободно гуляющих электронов;
- высокая плотность вещества (кроме щелочных металлов);
- пластичность — это смещение слоев кристаллической решетки.