Галогеналканы
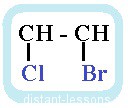
Галогеналканы (алкилгалогениды) — органические соединения, которые содержат в своём составе связь «углерод-галоген»
Т.к. галогеналканы -это производные алканов, в котором один или несколько атомов водорода (H) заменены на атом галогена, то их
общая формула:
n — количество атомов углерода (≥1),
Х — F, Cl, Br или J
Номенклатура галогеналканов
согласно ИЮПАК:
- указывается номер атома, к которому крепится галоген;
- называется сам галоген;
- называется углеводород соответственно количеству атомов
(если галогенов несколько, то их названия указываются в алфавитном порядке):
1-бром-2 — хлорэтан
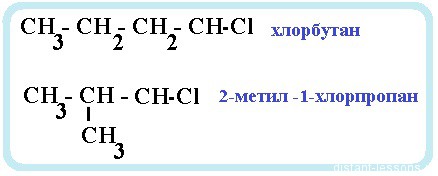
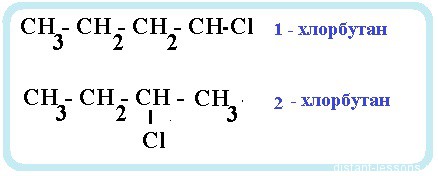
Изомерия галогеналканов:
- изомерия углеродного скелета:
- положения функциональной группы (в данном случае галогена):
Физические свойства:
Большинство галогеналканов — бесцветные (или желтоватые) вещества.
Чем больше атомов углерода, тем выше температуры плавления и кипения.
Химические свойства галогеналканов:
- Реакция Вюрца:
1 вариант -реакция удвоения углеводородной цепи:
CH3Cl + 2Na + ClCH3 → C2H6 + 2NaCl
2 вариант — просто удлинение цепи на любое количество атомов:
СH3Cl + 2Na + ClC3H7 → C4H10 + 2NaCl
- Взаимодействие с щелочами :
СH3Cl + NaOH (водн)→ СH3OH + NaCl — с образованием спиртов
СH3-СH2Cl + NaOH (спиртовой)→ СH2=СH2 + NaCl + H2O — с образованием алкенов
- Взаимодействие с ароматическими соединениями:
СH3Cl + C6H6 → C6H5-СH3 + HCl
- Горение галогеналканов:
4C2H5Сl + 13O2 = 8CO2 + 10H2O + 2Cl2
- Реакции с аминами:
СH3Cl + СH3NH2 → [СH3NH2 СH3]+Сl—
Получение галогеналканов:
- Хлорирование алканов на свету:
СH4 + Сl2 → СH3Cl + HCl
механизм этой реакции — радикальный - Гидрохлорирование ненасыщенных углеводородов:
СH2=CH2 + HCl → СH3Cl - Получение из спиртов:
СH3ОН + HCl → СH3Cl + H2O