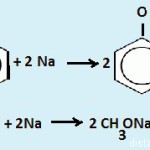
Задачи на спирты
Спирты в органической химии довольно разные и, соответственно, отличаются по химическим свойствам. Давайте рассмотрим основные примеры .
Задачи на спирты
Отличия в свойствах первичных и вторичных одноатомных спиртов
Задачи на спирты №1
Какой бы ни был вопрос в задаче (определить массу, объем или процентный состав), задача указывает на разные свойства данных спиртов — на различную способность окисляться.
Такое различие возможно для первичных, вторичных и третичных спиртов:
- первичные спирты окисляются до альдегидов, которые дают реакцию серебряного зеркала:
R-CH2-OH + [O] → R-COH
- вторичные спирты окисляются до кетонов — широко используемый растворитель органических веществ с характерным запахом и легколетучий — ацетон:
СH3-CH(OH)-CH3 + [O] → CH3-C(O)-CH3
- третичные спирты практически не подвергаются окислению.
Отличия в свойствах одноатомных и многоатомных спиртов
Задачи на спирты №1
Опять, какой бы вопрос не был поставлен в задаче, суть решения будет сводиться к тому, что:
- одноатомные спирты практически не взаимодействуют с щелочами;
- многоатомные спирты — вступают с ними в реакцию:
HO-CH2-CH2-OH + 2NaOH → NaO-CH2-CH2-ONa + 2H2O
Теперь разберем количественные задачи на спирты
1. Задача на спирты (определение формулы) по уравнению реакции:
2R-OH + 2Na → 2R-ONa + H2
Зная количество моль спирта, мы сможем найти его Mr, а значит, его формулу.
Количество моль спирта мы можем найти из количества моль водорода:
n(H2) = V \ 22.4 л\моль = 5.6 \ 22.4 = 0,25 мол
n(R-OH) = 2n ((H2) = 0.5 моль
Mr(R-OH) = m\n = 30 \ 0.5 = 60 г\моль
Общая формула одноатомных предельных спиртов — CnH2n+1OH
подставляем в формулу молярной массы:
12n + 2n + 1+ 17 = 60
n= 3 (пропанол)
2. Задача на спирты (определение формулы) по % содержанию элементов:
В молекуле одноатомного спирта всего 1 атом кислорода. Мы можем составить пропорцию для нахождения Mr соединения:
Ar(O) — 34.78%
Mr — 100%
Mr = 16*100\ 34.78 = 46 г\моль
находим массу углерода: 46*0.5218 = 24 г — это соответствует 2 атомам С (атомная масса каждого — 12);
находим массу водорода: 46*0.1304 = 6 г — это соответствует 6 атомам Н (атомная масса атома водорода — 1 г\моль);
наш спирт — С2H5OH — этанол
3. Задача на спирты (определение формулы) по продуктам горения:
Когда мы уравниваем реакции горения для кислородсодержащих соединений, проще сгруппировать все атомы — R-OH записываем как CnH2n+2O:
CnH2n+2O + O2 → nCO2 + (n+1) H2 O
находим количество моль каждого вещества:
n (cпирта) = V \ 22.4 = 0.0446 моль
n(CO2 ) = m \ Mr = 3.95 \ 44 =0.089 моль
n(H2 O) = m\Mr=2.44\18=0.135 моль
CnH2n+2O + O2 → nCO2 + (n+1) H2 O
0.0446 0.089 0.135 моль
n = 0.089 \ 0.0446 = 2
(можно еще проверить соотношение воды к спирту — получится 3, т.е. 6 атомов H)
cпирт С2H5OH — этанол