Подгруппа Бора
По старой классификации (по общепринятой в России периодической системе элементов) — элементы главной подгруппы III группы
По новой (точнее, международной) — химические элементы 13-й группы.
Подгруппа Бора
По номеру, как говорится, и свойства! Группу «раздирают внутренние противоречия»! Мы это разберем подробно, но пока рассмотрим общие закономерности.
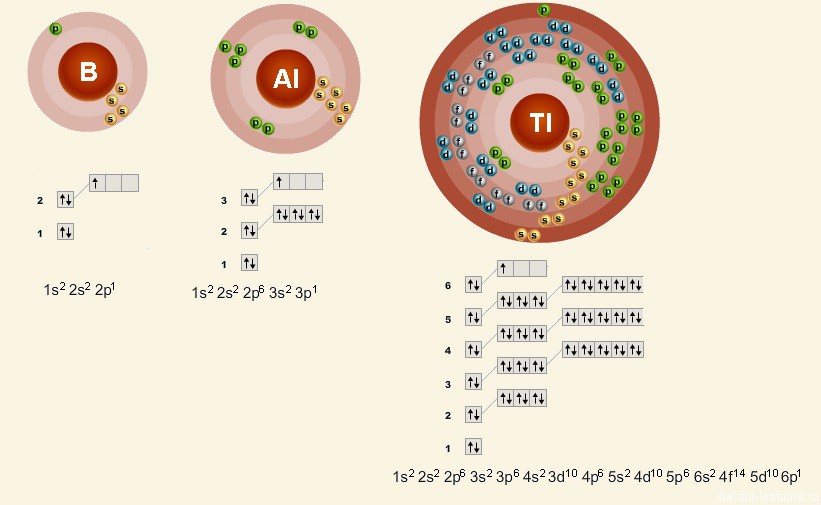
Электронное строение атомов
Электронное строение внешнего слоя у всех атомов этих элементов одинаково – на нем всего 2 электрона на s-орбитали 1 на p-орбитали:
n S2 n p1
Что это означает?
- Валентности элементов подгруппы бора = 3, т.е. каждый атом может образовывать 3 связи.
- Степени окисления элементов +3 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Tl более сильный металл, чем B.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства
А вот теперь о » внутренних противоречиях»
- Наличие p-орбитали уже вносит значительные изменения в химические свойства элементов. В отличие от металлов I группы и щелочноземельных металлов, где все элементы более или менее одинаковы, в подгруппу Бора закрался «предатель» — Бор — неметалл, по своим свойствам он больше похож на углерод С и кремний Si. Остальные элементы — металлы, хотя некоторые соединения алюминия проявляют амфотерные (т.е. и основные, и кислотные) свойства.
- Tl в отличие от остальных собратьев чаще проявляет степень окисления +1. ( В ЕГЭ он встречается ОЧЕНЬ редко, но знать об этом на всякий случай следует)
- Оксиды и гидроксиды: B2O3 — кислотный оксид, ему соответствует кислота H3BO3 (ее часто записывают как B(OH)3 — у этого соединения свойства амфотерные);
Al2O3 ( и оксид Ga) — амфотерный оксид — может реагировать как с кислотами, так и с растворами щелочей;
Оксиды In и Tl — типичные основные оксиды.
Как видите, сверху вниз в подгруппе закономерно усиливаются металлические свойства (основные) и ослабевают неметаллические (кислотные) — периодичность налицо!
Физические свойства элементов подгруппы бора — B и Al:
Общие характеристики:
- все металлы, кроме B — сероватого серебристого цвета; B — кристаллическое вещество, цвета: бесцветный, серый, красный…(различные аллотропные модификации)
- достаточно твердые, ножом, как щелочные металлы, их , конечно, не порежешь
 Бор чуть менее твердый, чем алмаз
Бор чуть менее твердый, чем алмаз - плотность больше 2,
- B встречается в природе только в виде соединений; Al покрываются оксидной пленкой, остальные — достаточно устойчивы.
- Электро- и теплопроводны
Химические свойства бора и алюминия
| свойства Бора | свойства Алюминия | |
| реакции с неметаллами: | инертен, при н.у. взаимодействует только с F2: 2B +3 F2= 2BF3 при нагревании:4B + 3O2 = 2B2O3 |
при н.у. покрывается оксидной пленкой, поэтому слабоактивный 6Al + 3O2 = 2Al2O3 |
| реакции с кислотными оксидами: | только при нагревании:10B + 3P2O5 = 5B2O3 + 6P т.е. бор проявляет восстановительные свойства |
— |
| реакции с кислотами: |
|
Концентрированными кислотами пассивируется: 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 |
| оксид | оксид бора B2O3 — кислотный оксид:B2O3 + 3H2O = 2H3BO3 | Al2O3 — амфотерный оксид: реагирует и с кислотами, и с щелочами |
| реакции с щелочами | — | 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 т.е. алюминий проявляет амфотерные свойства |
[TESTME 26]

+1+3-1
В NaBH4 Бор будет образовывать 4 связи с водородом (одна -донорно-акцепторная, как в аммиаке), при этом степень окисления будет равна +3
Спасибо большое 🙂
Всегда пожалуйста! 🙂
«А ЕГЭ он встречается ОЧЕНЬ редко» опечатка
спасибо! Исправили! 🙂
оксид бора Al2O3 — амфотерный оксид: реагирует и с кислотами, и с щелочами
Лолита Витальевна, объясните пожалуйста, вот Al может реагировать с кислотой и основанием, проявляя амфотерность, а с оксидами он вообще не реагирует, верно? Я имею ввиду именно сам Al, а не его оксиды и гидроксиды.
может при сплавлении: 2Al + Cr2O3 = Al2O3 + 2Cr ( см. ряд активности)
Ну это алюминотермия. Спасибо)