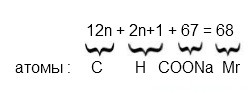Определение формулы вещества
Задача С5 ЕГЭ по химии — это определение формулы органического вещества. Есть несколько видов таких задач:
-
определение состава вещества по массовой доле элементов;
-
определение формулы вещества по относительной плотности;
-
определение формулы вещества по количеству молей (дано уравнение реакции, масса или объем)
Давайте разберем все три типа на конкретных примерах реальных заданий ЕГЭ прошлых лет и пробных этого года.
Определение формул веществ
1. Определение формулы вещества по массовой доле элемента
В таких задачах обычно дана массовая доля того элемента, количество которого является константой у данного вещества, например:
- в спиртах постоянное количество атомов кислорода ( у одноатомных — 1, у двухатомных — 2 и т.д.);
- в альдегидах и кетонах всегда 1 атом кислорода;
- в карбоновых кислотах — 2 атома O;
- в аминах, так же как и в нитро-соединениях — один атом азота.
Общая формула натриевой соли предельной карбоновой кислоты:
СnH2n+1COONa
Т.е. вещество содержит всего один атом натрия:
Ar(Na) — 33.82%
Mr(вещества) — 100%
Mr = 23*100\33.82 = 68 г\моль
Подставляем это значение в общую формулу вещества:
12n +2n+1 + 67 = 68
определение формулы вещества
получается, что n=0, значит, формула вещества:
HCOONa — формиат натрия
—————————————————————————————————————————————————————
2. Определение формулы вещества по относительной плотности
(подробно такие задачи мы уже разбирали ЗДЕСЬ…)
А вот комбинированная задача — здесь и массовые доли, и плотность:
По относительной плотности по воздуху определяем Mr(вещества):
Mr(CxHyOz) = 2.55*29 = 74 г\моль
Теперь определяем содержание в веществе кислорода, водорода и углерода:
x(C) = Mr*ω \ Ar(C) = 74*0.4865\12 = 3
y(H) = Mr*ω \ Ar(H) =74*0.0811\1 = 6
z(O) = Mr*ω \ Ar(O) = 74*0.4324\16 = 2
получаем общую формулу вещества: C3H6O2
В задаче просят привести формулы всех возможных изомеров для этого вещества. Два атома кислорода в формуле определяют вещество как кислоту или сложный эфир:
СН3 – СН2 – СООН — пропановая кислота
СН3 – СОО – СН3 — эфир — метилацетат
Н – СОО – С2Н5 — этилформиат
———————————————————————————————
3. Определение формулы вещества
при заданном уравнении реакции
Наша задача — найти Mr (вещества). По уравнению реакции мы можем найти количество моль, следовательно, используя формулу Mr=m\n, найдем молярную массу.
СnH2n+1OH + HCl = CnH2n+1Cl + H2O
Как видно из уравнения реакции, все вещества реагируют 1:1, значит, количества моль равны.
n(H2O) = m\Mr = 6.75\18 = 0.375 моль
n( CnH2n+1Cl ) = n(H2O) = 0.375 моль
Mr ( CnH2n+1Cl ) = m\n = 39.94\ 0.375 = 106.5 г\моль
Подставляем в уравнение молярной массы вещества:
12n + 2n+1 + 35.5 = 106.5
n = 5
C5H11OH — пентанол
Для тренировки порешайте несколько таких задач: