Задачи на массовую долю
Задачи на массовую долю
Есть 2 вида задач на массовую долю:
- массовая доля элемента в соединении;
- массовая доля вещества а растворе
Общая формула массовой доли :
1. Задачи на массовую долю элемента в соединении:
Для нахождения ω нам нужно найти массу углерода, массу водорода и, конечно, массу всей молекулы.
Масса углерода, входящего в состав данного углеводорода (гексена) будет складываться из суммы атомных масс 6 атомов углерода:
m(C) = 6Ar(C) = 6• 12 = 72 г\моль
Масса водорода будет складываться из суммы атомных масс 12 атомов водорода:
m(H) = 12Ar(H) = 12• 1 = 12 г\моль
Молярная масса всего вещества будет равна: Mr(C6H12)=72+12 = 84 г\моль
ω (H) = m(H) \ m(C6H12)
ω (H) =12\84 = 0,14 14%
ω (C) = m(C) \ m(C6H12)
ω (C) =72\84 = 0,86 86%
_______________________________________________________________________________________________________________________________
Это обратная задача на массовую долю — по количеству каждого элемента нужно определить формулу вещества.
Общая формула оксида железа — FexOy.
Для определения формулы нам нужно найти соотношения х к y. Естественно, это должны быть целые числа
- Масса железа будет вычисляться по формуле: m(Fe) = m(вещества)• ω(Fe);
- масса кислорода — точно так же: m(О) = m(вещества)• ω(О)
Чтобы найти количество атомов каждого элемента, нужно их массы разделить на атомные массы ( m(вещества) сократится):
Первый вариант:
x : y = 1 : 1, т.е. формула оксида железа будет FeO
x : y = 1 : 1,5 = 2:3 оксид — Fe2O3
x : y = 1,29 : 1,725 = 3:4 оксид — Fe3O4
_______________________________________________________________________________________________________________________________
Итак, у нас соединение состава MeClх
по формуле массовой доли: ω(Cl) = m(Cl) \ m(MeClх)
m(Cl) = Ar(Cl)•x
m(MeClх) = Ar(Me) + Ar(Cl)•x
0.747 = 35.5 • x \ (Ar(Me) + 35.5 • x)
Ar(Me) = 12x
если х=1, то Ar(Me) = 12 — такого металла нет, если если х=2, то Ar(Me) = 24.
По таблице Менделеева Ar 24 соответствует Mg. Наше вещество — MgCl2.
- задание ГИА (ОГЭ) по химии — А15

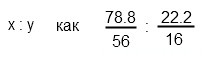
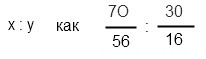
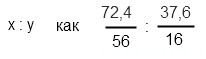



Здравствуйте, Лолита Витальевна!
Давно к вам не заходила. Завтра экзамен по химии, сижу, разбираю варианты. Не могу решить задачу, помогите пожалуйста.
К 150 г. раствора с массовой долей магния 10% добавили 15 г. этой же соли и выпарили 45 мл. воды. Массовая доля в полученном растворе равна_______%
Добрый день! Очень вам рада!
массовая доля = масса вещества \ раствора
w= (150*0.1 + 15)\(150+15-45)=30\120=0.25 т.е. 25%
Большое спасибо, я сначала так и хотела, только меня смутили мл., думала их надо в граммы переводить
т.к. у воды плотность принята=1, то мл спокойно переводим в граммы, литры в килограммы 🙂
Здравствуйте, помогите пожалуйста решить задачу(
определите название и массу соли, которую можно получить при пропускании 100 м кубических коксового газа, содержащего 15 % аммиака через 10 л 78%-ного раствора серной кислоты (плотность которого=1,704г/мл) мне очень надо помогите как сможете
2NH3 + H2SO4 = (NH4)2SO4 — сульфат аммония
m(H2SO4)=V*D*w = 10000 мл * 1,704 г/мл *0.78 = 13291,2 г
n(H2SO4)=m\Mr = 13291,2 г \ 98 г\моль = 135,6245 моль
по уравнению реакции столько же и соли
m(соли )=n*Mr
Помогите!
Какую массу 40 % раствора соли надо добавить к 90% раствору массой 2000 гр, чтобы получить 50 % раствор?
Добрый день!
Все очень просто: формула массовой доли: w=m(вещества)\m(раствора). Масса раствора — это масса вещества и масса растворителя, например, воды.
Вопрос про массу, значит, обозначаем массу раствора за x. 40%-ный раствор, значит, масса вещества = 0.4х
Второй раствор — масса 2000 г, 90%, значит, масса вещества = 2000*0.9 = 1800 г
При сливании получаем новый раствор: масса вещества — будет сумма масс веществ двух растворов: 0.4х + 1800 г
Масса раствора будет тоже суммой масс двух растворов: х + 2000
Получаем, что массовая доля 50% это w=0.5= (0.4х + 1800) \ (х + 2000)
х=8000 г
Понятно решение?
Здравствуйте, помогите пожалуйста
Смешали один объём HCl массой 250г и w 8% с одним объёмом HCl массою 300г и w 12%. Нужно найти общюю массу
Доброго времени суток!
Не совсем понятно условие «найти общую массу» — массу чего — вещества в получившемся растврре или массу раствора?
Смотрите: m (вещества)=m(раствора)*w
первый раствор НСl — m1(HCl)= 250*0.08=20 г
второй раствор: m2(Hcl) = 300*0.12= 36 г
полученный раствор: m(HCl)=m1 + m2 = 20+36=56 г
m(раствора)= 250+300=500 г
и очень смущает формулировка «смешали один объем …с одним объемом…»
Добрый вечер!!!помогите пожалуйста.
Зад№1. после растворения навески сплава массой 0,8540 г,объем раствора довели до 250 см3.На титрование 50см3 этого раствора было израсходованно 25,50 см3 раствора NH4CNS с сонцентрацией=0.5 моль/дм3.Определить массовую долю серебра в сплаве?
Зад№2. Определить титр HNO3 /K2O раствора азотной кислоты,полученного при смешении 65,40 см3 31,37 процентного (плотность =1,19 г/см3) раствора азотной кислоты и раствора объемом 85,60 см3 с титром HNO3/ MgO=0,06835 г/см3 .
1. Ag(+) + NH4CNS = Ag(SCN) + NH4(+)
V(NH4CNS)= 0.0255 л
С = 0.5 моль/л
n((NH4CNS))=C*V = 0.05 моль/л* 0.0255 л = 0,001275 моль
по уравнению реакции n(Ag(+))= n(NH4CNS)= 0,001275 моль
Если было израсходованно 0.05 л раствора, значит, его концентрация С = 0,001275 моль \ 0.05 л = 0,0255 моль\л
Раствор навески взяли 0.25 л, значит, n= C*V=0,0255 моль\л*0.25 л = 0,006375 моль
m(Ag)=n*Ar = 0,006375 моль* 108 г\моль = 0,6885 г
w=m(Ag)\m(cплава)= 0,6885 г\0,8540 г = 0.8 или 80%
2 задача. Титр — не школьный материал. Напишите формулу определения титра, тогда сможем помочь с задачкой
Определяли содержание кобальта в сплаве кулонометрическим
методом. При этом в серебряном кулонометре выделилось 0,0755 г
серебра. Определить массовую долю Со в сплаве, если масса навески
сплава равна 1,5000 г
Задача НЕ ШКОЛЬНОГО уровня — там кулонометрию не проходят. Здесь помогают в подготовке к школьным экзаменам.
Ag(+) +1e -> Ag(0)
Co (0) -2e = Co(2+)
а дальше идут элементарные формулы школьного курса:
n(Ag)=m\Ar = 0.0755 \ 108= 0.0007 моль
n(C0)=1\2n (Ag)= 0.00035 моль
m(Co)=n*Ar
w(Co)=m(Сo)\m(сплава)
нужно придумать задачи на смешение растворов.по схеме соль + раствор, Н2О+раствор, раствор + раствор,и найти во всех задачах нужно массовую долю.Растворы любые.Заранее спасибо.
Это задачи не уровня ГИА и ЕГЭ, поэтому нет смысла публиковать такое на сайте. А в интернете полно подобных примеров…
Установить истинную формулу углеводорода, если при сжигании 8,6г его образовалось 26,4г СО2 и 12,6г Н2О. Плотность паров этого углеводорода по водороду равна 43.
По плотности по водороду определяем Mr:
Mr(CxHy) = 2*43 = 86 г\моль
CxHy + O2 = xCO2 + y\2 H2O
n(CxHy) = m\Mr = 8.6\86 г\моль = 0.1 моль
n(CO2) = m\Mr=26.4\44 = 0.6 моль
n(H2O) = m\Mr = 12.6\18 = 0.7 моль
получаем, что х=6, y=14
Здравствуйте, помогите решить такую задачу: для определения меди в сплаве взяли навеску его массой 0,2152 граммов. Из нее методом электролиза получили осадок чистой меди массой 0,0898 г. рассчитайте содержание меди в сплаве в процентах
0,2152 — 100%
0,0898 — х
х=41,73 %
СПАСИБО БОЛЬШОЕ
Успехов!
Помогите решить задачу)
При электролизе 200г раствора сульфата меди (//) последовательно наблюдали уменьшение массы р-ра на 8 г . Вычислите массовые доли соединений в р-ре и массы вещ-в, выделившихся на инертных электродах.
2CuSO4 + 2H2O ->(электролиз)-> 2Cu + O2 + 2H2SO4
8 г — это уменьшение массы CuSO4 — то кол-во, которое вступило в реакцию
Находите кол-во моль сульфата — n=m\Mr
n(Cu)=n(CuSO4)
n(O2) = n(CuSO4)\2
Находите массы выделившихся веществ
масса раствора будет равна: 200 г-m(Cu)-m(O2)
массовая доля каждого вещества будет равна m(вещества)\ m(раствора)
Можете написать эту задачу по подробней ? Не могу понять
Аружан, напишите, пожалуйста, что именно Вам не понятно? С какого момента?
Здравствуйте!помогите пожалуйста решить задачу. Навеску минерального удобрения содержащего калий 2 г растворили в кислоте и перенесли в мерную колбу вместимостью 500мл, далее аликвотную часть раствора объемом 5 мл перенесли в мерную колбу на 250 мл. Определение калия проводили методом пламенной фотометрии. Построить градуировочный график и определить массовую долю калия в минеральном удобрении. (по графику при аналитическом сигнале,контрольный раствор, 18,4 мг/мл, массовая доля равна=12%).
к сожалению, не сможем помочь — задача НЕ школьного уровня… 🙁
жаль….
Вы же уже поступили — у вас и учебники, и митодички — все для решения задач есть! 🙂
Добрый вечер!
1.Массовая доля брома, которая входит в состав дибромпроизводного насыщенного углеводорода, составляет 79.21 % Определите формулу дибром производного алкана.
Общая формула алкана — CnH2n+1Br
Ar(Br) — 79.21%
14n+1+81 — 100%
находите n — кол-во атомов С Такие задачи здесь рассмотрены: http://distant-lessons.ru/opredelenie-formuly-veshhestva.html
Для приготовления 100л бордской жидкости берут 1 кг негашеной извести и 1 кг медного купороса. Негашеную известь предварительно гасят небольшим количеством воды. Затем проводят реакцию
4CuSO4 + 3Ca(OH)2 = CuSO4* 3Cu(OH)2 + 3CaSO4.
Вычислите массовую долю гидроксида-сульфата меди в полученной бордской жидкости, если ее плотность принять равной 1г/мл.
Добрый день!
негашеная известь: CaO
CaO + H2O = Ca(OH)2 — гашение извесит
n(CaO) = m\Mr
n(Ca(OH)2 = n(CaO)
4CuSO4 + 3Ca(OH)2 = CuSO4* 3Cu(OH)2 + 3CaSO4.
смотрим, какое количество моль в недостатке. По нему находим n(CuSO4* 3Cu(OH)2)
находим массу
w = 100% * m(CuSO4* 3Cu(OH)2))\(100000 мл*1 г\мл
n(CuSO4)=m\Mr
Для определения массовой доли H2SO4 взяли массу навески 0,6424г после осаждения был получен осадок BaSO4 массой 0,5284г. Найти массовую долю H2SO4.
взяли навеску H2SO4?
H2SO4 + Ba(2+) = BaSO4 + 2H(+)
n(BaSO4) = m\Mr
n(H2SO4) = n(BaSO4)
m(H2SO4) = n*Mr(H2SO4)
w = 100%*m(H2SO4) \ m (нвески)
К 120 г раствора KOH c w-15% добавили 32,4 г твердого KOH. Какова молекулярная концентрация раствора, если p-1,32г/мл?
Ну. начнем с того, что в школе молекулярную концентрацию не проходят, да и молекулярной концентрация не бывает. Бывает мольная, молярная…
Допустим, вам нужна молярная
С=n\V
кол-во моль n=m (вещества )\Mr
V=m (раствора)\p
m(вещества) = 120*0.15 + 32.3 г
m (раствора) = 120 + 32.4 г
Дальше просто подставляйте в формулу
правильный ответ 0,008 моль/л, да?
да, если округлить
Какую массу 20% и 30% растворов хлорида натрия необходимо взять для приготовления 400 г раствора с массовой долей вещества 0,25?
w = 100% * m (вещества) \ m( раствора)
25 = 100* (0.2m + 0.3m)\2m
находите m — это и будет искомая масса раствора
К 250 мл 10% раствора серной кислоты (плотность 1, 07 г/мл) добавили 400 мл ее 20% раствора (плотность 1, 14 г/мл). Вычислите массовую долю кислоты в полученном растворе.
Все по той же формуле
w = 100% *m (вещества) \ m( раствора) = 100%*(w1*V1*p1 + w2*V2*p2)\ (V1*p1+ V2*p2)
Апельсиновый сок содержит 15% сахара. Сколько кг воды нужно добавить к 3л сока, чтобы содержание сахара стало 5%?
надо знать плотность раствора
w = 100%*m (вещества )\m(раствора)
5 = 100* (0.15*V\p)\(V\p + x)
х — масса воды
К 600 мл 20% раствора серной кислоты (плотность 1, 05 г/мл) добавили 400 мл ее 30% раствора (плотность 1,3 г/мл). Вычислите массовую долю кислоты в полученном растворе.
Вот материал по вашим вопросам -задачи только по числам различаются:https://vk.com/away.php?to=http%3A%2F%2Fdistant-lessons.ru%2Fzadachi-na-massovuyu-dolyu-veshhestva-v-rastvore.html
Какую массу 10% и 40% растворов хлорида натрия необходимо взять для приготовления 500 г раствора с массовой долей вещества 0,25?
Вот тема по вашему вопросу:
http://distant-lessons.ru/zadachi-na-massovuyu-dolyu-veshhestva-v-rastvore.html
w = 100% *m (вещества) \ m( раствора)
0.25 =(0.1m+0.4m)\500
При электролизе 200 г раствора сульфата меди (II) последовательно наблюдали уменьшение массы раствора: а) на 8 г. б) 16г.
в) на 25г, Вычислите массовые доли соединений в растворе и массы веществ, выделившихся на инертных электродах в каждом из рассмотренных случаев.
Добрый день!
Сначала нужно уравнение написать:
2CuSO4 + 2H2O = электролиз = 2Cu + O2 + 2H2SO4
масса раствора уменьшилась на массу кислорода.
Находите кол-во моль кислорода: n(O2)=m\M
в растворе остались медь и кислота
n(Cu)=2n(O2)
n(H2SO4)=2n(O2)
Находите массу веществ и массу раствора
массовая доля w = m (вещества) \ m( раствора)
Добрый день! Учитель любит составлять задачи. Вот её задача. Найти массу 0.01Мр-ра серной кислоты, если его объём 200 мл, массовая доля 10%. Пожалуйста помогите, или мы совсем уже ребенку не помощники, или каких-то данных не хватает.
Да нет, всего хватает — задача довольно простая:
Из концентрации найдем количество моль:
n=C*V = 0.01 моль\л * 0.2 л = 0,002 моль
m(H2SO4) = n*M = 98 г\моль*0.002 моль = 0,196 г
m (раствора H2SO4) = m(H2SO4)\0.1 = 1,96 г
Добрый вечер! помогите решить задачу! : Рассчитайте массу сплава с известной массовой долей алюминия, если при его взаимодействии с раствором щелочи выделяется водород объемом V(норм.условия).V(H2)=1см^3. массовая доля Al=75% . Состав сплава Al-Si
Доброго времени суток!
2 Al + 2 NAOH + 6 H2O = 2 NAAl(OH)4 + 3 H2
n(H2)=V\Vм = 0,001 л \ 22.4 л\моль = 0.000045 моль
n(Al)=2\3n(H2) =0,0003 моль
m(Al)=n*Ar(Al)=0,0003*26 г\моль = 0,0078 г
m( сплава) = m(Al)\0.75 = 0,0104 г
Спасибо Вам огромное !
Павел, я там в первый раз немного ошиблась в уравнивании, исправила. Посмотрите, пож-та, исправленный вариант
Здравствуйте! уже давно пытаюсь решить,ничего в голову не приходит(может вы сможете помочь
Какой объем 1.4М раствора NaCl,плотность кот. =1.054,необходимо добавить к 200мл 3.9М(плотность=1.145)раствора NaCl для получения 2.7М ра-ра NaCl(плотность полученного=1.099)
ответ 183мл
нашла массу и кол-во второго раствора т.к. известен объем,а что делать дальше не могу понять(как вообще что то найти,зная только концентрацию и плотность(
Масса 0,2 л 3,9 М раствора равна 0,2*1145=229 г.
Масса х л 1,4 М раствора равна 1054*х г.
Масса полученного раствора равна (229+1054*х) г
Объем полученного раствора равен (229+1054*х) /1099 л
Вновь составляем баланс по NaCl
0,2*3,9+х*1,4= (229+1054*х) /1099*2,7
0,78+1,4*х=0,5626+2,589*х
1,189*х=0,2174
х=0,2174/1,189=0,1828
Ооо,здорово,огромное спасибо!!
Здравствуйте.Помогите пожалуйста.Пока болел,пропустил несколько тем.m(в-ва)-42г m H2o-16г .W-? .И еще одна задача Дано: CuH2 H2O.Найти W(H).формулу смотрел (масса вещества деленая на массу раствора),но не понял ,что делать.Химия первый год.Спасибо
Добрый день!
Массовая доля w = 100%* m( вещества) \ m (раствора). Масса раствора — это сумма масс вещества и растворителя ( в данном случае воды). Получаем:
w = 100%* 42 \ (42+16)
Вторая задача — нужно найти массовую долю водорода в веществах.
В данном случае массовая доля H равна w = n*Ar(H)\M( вещества)
n — кол-во атомов водорода, Ar — атомная масса водорода, M — молярная масса вещества (сумма атомных масс)
БОЛЬШОЕ спасибо.Очень помогли
Здравствуйте,прошу у вас помощи
8% водный раствор CuSO4.Плотность раствора 1,08 г/см3(степень).
Вычислить мольную долю(%) вещества в растворе,а также молярную концентрацию, эквивалентную концентрацию и моляльность раствора
Если не затруднит с небольшим объяснением.
Плотность p=m\V
8% по массе? тогда m вещества = 0.08*p*V раствора
Молярная концентрация С = n\V (n-кол-во моль)
n=m\M, используем формулу плотности: n=0.08*p*V \ M(CuSO4)
С = 0.08*p \ M(CuSO4)
Эквивалентная концентрация (нормальность) = С(eq) = n(eq) / V , формула та же, но n(eq) = 1\2 n? т.к. валентность меди = 2
Моляльная концентрация mi = n / m