23-Окт-2012 | Нет комментариев | Лолита Окольнова
Серная кислота химические свойства
Формула серной кислоты — H2SO4
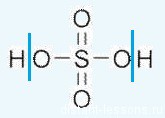 Очень сильная кислота, к тому же это кислота-окислительь.
Очень сильная кислота, к тому же это кислота-окислительь.
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
- М (металл до водорода) + H2SO4 = соль и выделение водорода: 2Na + H2SO4 = Na2SO4 + H2↑
- Основной оксид+ H2SO4 = соль + вода: MgO + H2SO4 = MgSO4 + H2O
- Основание+ H2SO4 = соль + вода: 2NaOH + H2SO4 = Na2SO4 + 2H2O

Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
- С металлами — окисляет металл, сама восстанавливается до SO2:
Сu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
- C неметаллами:
S + 2H2SO4(конц) = 3SO2 + 2H2O;
- С оксидами неметаллов:
СO + H2SO4 = CO2 + SO2 + H2O
- C кислотами — неокислителями:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
Серная кислота и вода

C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
- Средние: все атомы водорода замещены на металл: Na2SO4
- Кислые: от кислоты остался один водород: NaHSO4 — гидросульфат натрия.
Переход средняя соль —-> кислая соль:
Na2SO4 + H2SO4 = 2NaHSO4
Переход кислая соль —->средняя соль:
2NaHSO4 = (t) = Na2SO4 + H2SO4
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.
19-Окт-2012 | комментария 4 | Лолита Окольнова
Азотная кислота
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:

4HNO3 = 4NO2 + 2H2O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
17-Окт-2012 | Один Комментарий | Лолита Окольнова
Все-таки удивительный элемент углерод! То, что он основа органической жизни на Земле — знают все, но давайте проанализируем его соединения и их разнообразные свойства…
Какова же роль углерода в природе, в жизни и т.д.?
Углерод — основа жизни на
Земле
09-Окт-2012 | Нет комментариев | Лолита Окольнова
Людей, перешагнувших 100-летний рубеж не так уж и много, хотя, безусловно, такие экземпляры встречаются. Особенно среди горцев 🙂
А как обстоит дело в животном мире?
10-Сен-2012 | комментариев 6 | Лолита Окольнова
Вопрос «Как эффективно подготовиться к экзамену» мне задают ОЧЕНЬ часто, есть несколько мнений по этому поводу, я озвучу здесь свое личное мнение, которое за 7 лет работы принесло определенные хорошие результаты.

08-Сен-2012 | Нет комментариев | Лолита Окольнова
Задачи на фенолы
Фенолы отличаются от алифатических спиртов наличием бензольного кольца и исключительно кислотными свойствами -OH — группы (т.е. отщепляется только водород).
Задачи на фенолы пример №1

Внимание: с бромной водой будет реагировать только фенол (качественная реакция) !
С6H5-OH + Br2 = C6H4Br(OH) + HBr
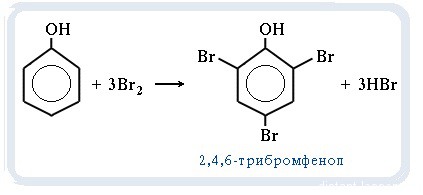
Т.е. выпавший осадок массой 33.1 г — 2,4,6-бромфенол.
n(C6H2Br3(OH))=m\Mr=33.1\331 = 0.1 моль
n(C6H5OH)=n(C6H2Br3(OH))= 0.1 моль
m(C6H5OH)=n*Mr = 0.1*94=9.4 г
Значит, масса ароматического углеводорода m = m(cмеси) — m(C6H5OH) = 14-9.4 = 4,6 г
Mr(CnH2n-6)= m\n=4,6 \ 0.05 = 92
Подставляем значение молярной массы в общую формулу аренов:
12n + 2n -6 = 92
14n=98
n=7
C7H8 — толуол
Задачи на фенолы пример №2
|
При обработке 4,18 г смеси бензилового спирта, крезола и фенола избытком калия выделилось 448 мл (н.у.) газа. Вычислите массовую долю фенола в исходной смеси.
|
Итак, сначала определимся с формулами:
бензиловый спирт: С6H5CH2OH:
крезол: С6H4(CH3)OH
фенол: С6H5OH:
Бензиловый спирт С6Н5СН2ОН и крезол СН3С6Н4ОН являются изомерами состава С7Н8О. Их массу в смеси обозначим через х, а объем выделившегося водорода – у, тогда реакцию изомеров с калием можно записать одним уравнением:
2C7H7OH + 2K = 2C7H7OK + H2
В реакции фенола с калием масса фенола (4,18 – х) г, а объем выделившегося водорода
V(Н2) = z л.
2С6H5OH+2K=2C6H5OK+H2
Всего в реакциях выделилось 0,448 л газа: у + z = 0,448 л,
22,4х/(2*108) + 22,4*(4,18 – х)/(2*94) = 0,448.
Отсюда х = 3,24 г.
Масса фенола равна: 4,18 – 3,24 = 0,94 г.
Массовая доля фенола в смеси:
w(С6Н5ОН) = 0,94/4,18 = 0,225, или 22,5%.
Далее считаем сколько водорода выделилось при реакции с фенолом и по разности находим объем водорода выделяемый смесью бензилового спирта и крезола массой 3,24 г. Составляем еще одну систему уравнений.
_______________________________________________________________________________________________________________
Как видите, все задачи на фенолы сводятся к отличительным особенностям их химических свойств.
07-Сен-2012 | Нет комментариев | Лолита Окольнова
Спирты в органической химии довольно разные и, соответственно, отличаются по химическим свойствам. Давайте рассмотрим основные примеры .
Задачи на спирты
04-Сен-2012 | комментариев 8 | Лолита Окольнова
30-Авг-2012 | комментария 2 | Лолита Окольнова
И снова пост об овр, или
окислительно-восстановительных реакциях.
24-Авг-2012 | Один Комментарий | Лолита Окольнова
Очень часто школьники задают мне вопросы по биологии — части С ЕГЭ.
Как правильно отвечать на вопросы этой части, это ведь почти мини-сочинение и т.д.
 Очень сильная кислота, к тому же это кислота-окислительь.
Очень сильная кислота, к тому же это кислота-окислительь.





