Классы неорганических соединений
Классы неорганических соединений
Это очень важная тема в неорганической химии и в учебниках, и в интернете, но здесь я хочу показать именно практическое применение классификации. Так что, давайте разбираться!
Основные классы неорганических соединений:
простые вещества;
сложные вещества:
- оксиды;
- основания;
- кислоты;
- соли
Давайте сразу разберем эту схему на примерах:
У нас есть простые вещества:
- металлы: Na, например
- неметаллы: S
При взаимодействии с кислородом (O2) образуются оксиды:
- из металлов образуются основные оксиды: 4Na + O2 = 2Na2O
- из переходных элементов (диагональ о Be к At) — амфотерные оксиды — Al2O3
- из неметаллов образуются кислотные оксиды — SO2
- также из неметаллов образуются несолеобразующие оксиды: 2С + O2 = 2CO
Названия оксидов очень логичны — из основных оксидов образуются основания — соединения с- OH — группой:
Na2O + H2O = NaOH
( Me(OH)x — общая формула. Х= степени окисления металла. Заряд группы -OH= -1)
Систематическое названия — гидроксиды;
Растворимые основания называются щелочи.
Кислотные оксиды при взаимодействии с водой дают кислоты — соединения, у которых в начале молекулы стоит Н — водород: SO2 + H2O = H2SO3
(Когда пишите уравнения взаимодействия, то просто складываете атомы: сначала H, потом неметалл, потом кислород)
Кислоты и основания при взаимодействии друг с другом дают соли: 2NaOH + H2SO3 = Na2SO3 + 2H2O
Эта реакция называется реакцией нейтрализации, т.к. кислота и щелочь дают соль и воду — «нейтрализуется» действие каждого из реагентов.
Амфотерные оксиды и несолеобразующие лучше разобрать отдельно… у них своя запутанная история 🙂
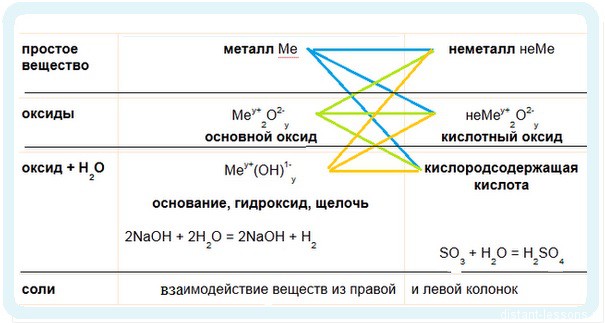
Есть еще одна довольно удобная табличка по взаимодействиям основных классов неорганических соединений:
Правый столбец — все, что относится к металлам и их соединениям.
Левый столбец — неметаллы и их соединения.
ВНУТРИ СТОЛБЦА РЕАКЦИИ НЕ ИДУТ!
(есть некоторые исключения — например, реакции оксидов и металлов d-элементов)
Т.е. основной оксид с основанием взаимодействовать не будет: Na2O + NaOH —> реакция не идет
кислота с кислотным оксидом взаимодействовать не будут: SO2 + H2SO3 —> реакция не идет
ВЕЩЕСТВА ИЗ РАЗНЫХ СТОЛБЦОВ РЕАГИРУЮТ МЕЖДУ СОБОЙ
Давайте эти реакции разберем подробнее…
1. Идем по синим стрелочкам
1. Металл + неметалл = соль:
2Na+ Cl2 = 2NaCl — хлорид натрия
2Na + S = Na2S — сульфид натрия
2. металл + кислотный оксид = оксид металла + неметалл/несолеобразующий оксид:
2Na + CO2 = Na2O + CO
Na + SO2 = Na2O + S
здесь суть в том, что металл окисляется кислородом кислотного оксида, а оксид, соответственно, восстанавливается металлом.
3. металл + кислота = соль + …
Здесь нам понадобится ряд активности металлов.
- Если металл стоит ДО ВОДОРОДА Н, то он вытесняет водород из кислот: 2Na + 2HCl =2 NaCl + H2
- Если металл стоит ПОСЛЕ ВОДОРОДА, то реакция идет без выделения H2: Сu + 4HNO3 = Cu(NO3)2 + NO2 +2 H2O
4. металл + соль = другая соль + другой металл
И опят нам нужен ряд активности металлов. Только предыдущий металл может вытеснить последующий из его соли:
2Na + MgCl2 = 2NaCl + Mg
Na + CaCl2 —> реакция не идет!
2. Идем по зеленым стрелочкам
1. Основной оксид + неметалл = металл/ оксид с меньшей степенью окисления + кислотный оксид/ несолеобразующий оксид
Na2O + S = 2Na + SO2
Fe2O3 + C = 2FeO + CO
здесь идет окислительно-восстановительный процесс — неметалл восстанавливает основной оксид, сам при этом окисляется
2. Основной оксид + кислотный оксид = соль
Na2O + SO2 = Na2SO3 — сульфит натрия (просто «складываем» количество атомов 🙂 )
3. Основной оксид + соль —> реакция не идет
3. Идем по желтым стрелочкам
1. основание + неметалл =…
Обычно такие реакции не идут. Исключение составляет NaOH и Cl2:
2. основание + кислотный оксид = соль
2NaOH + SO2 = Na2SO3 + H2O
3. основание + кислота = соль — РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ
NaOH + HCl = NaCl + H2O
4. основание + соль —> реакция идет, если образуется газ, осадок или малодиссоциирующее вещество
Как видите, в большинстве случаев реакции между веществами из двух столбцов приводят к образованию соли. Ну а исключения надо отдельно все разобрать, а некоторые выучить.
в ЕГЭ это задания:
- А7 — классификация органических и неорганических веществ.
- А8 — свойства простых веществ.
- А9 — химические свойства оксидов.
- А10 — свойства оснований и кислот.
- А11 — химические свойства солей.
- А12 — взаимосвязь неорганических соединений.
в ГИА (ОГЭ) по химии:
- А9 — Химические свойства простых веществ: металлов и неметаллов
- А10 — Химические свойства оксидов: основных, амфотерных, кислотных
- А11 — Свойства оснований и кислот
- А12 — Химические свойства солей (средних)
[TESTME 13]

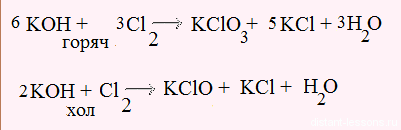

Здравствуйте, это снова я. И как всегда с вопросами))) Нужно составить структурные формулы следующих веществ:HClO4, HNO2, HBrO3, BCl3/ Или где посмотреть. Вообще, задание заключается в том, что нужно расположить вещества по увеличении числа связей в молекуле. Но ведь, чтобы это понять нужна структурная формула или я не права?
Здравствуйте! Вам здесь всегда рады :)))
Здесь нужно смотреть по валентности (валентность=кол-во связей).
HClO4 — 1 связь у H, 7 связей у хлора и у кислорода (каждого) — двойная связь
HNO2 — у водорода, как всегда 1, у азота — 3, у кислорода — двойная,
HBrO3 — у водорода, как всегда 1, 5 у брома и двойная от каждого кислорода
Bcl3 — только 3 связи.
Получается вот такая последовательность (увеличение кол-ва связей): BCl3 — HNO2 — HBrO3 — HClO4.
Для практики можно и нарисовать — я вам письмом рисунок на почту пришлю
Здравствуйте, Лолита! Скажите пожалуйста, а почему Вы пишите, что кислотные оксиды не реагируют с кислотами? Разве сернистый и фосфорный ангидрид с азотной кислотой не взаимодействуют?
Добрый день! В этом посте рассмотрены реакции присоединения, обмена и замещения по основным классам химических соединений.Кислоты — окислители — это отдельный разговор.
Зря я, конечно, в схеме указала именно кислород-содержащие кислоты, надо будет поправить, просто
разбор окислительно-восстановительных — немного другая тема, но она тоже есть на сайте
То есть это характерно только для кислот-окислителей? А ещё я не совсем поняла про окислительно-восстановительные. Реакция фосфорного ангидрида с азотной кислотой не окислительно-восстановительная. Там же степени окисления элементов не меняются… Какой тогда там механизм будет?
Да, конечно. Такие реакции характерны только для кислот- окислителей:
P2O3 + 2HNO3 = P2O5 + 2NO2 + H2O
1*\P(+3)-2e(-) -> P(+5)
2*\N(+5)+1e(-) -> N(+4)
Я имела в виду оксид фосфора (V). Там степени окисления не меняются:
2HNO3 + P2O5 = N2O5 + 5HPO3
такая реакция возможна только в теории — ОЧЕНЬ разбавленная азотная кислота может отдать воду, но на практике ангидриды и кислоты не обмениваются водой, и уж тем более кислот-сильные окислители.
Понятно. А значит ли это, что написание подобной теоретической реакции в ЕГЭ будет ошибкой?
Да, в ЕГЭ такие вопросы в части А встречаются и там все по той схеме, что указана на сайте — кислотные оксиды реагируют с производными металлов — оксидами и основаниями.