Химические свойства оксидов
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
|
Оксиды, образованные металлами |
Оксиды, образованные неметаллами |
||
|
Основные |
Кислотные |
Несолеобразующие |
|
— Na2O, CaO; |
Оксиды: Al2O3, ZnO, d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2 |
1) оксиды неметаллов в высших и средних степенях окисления CO2, N2O3, N2O5, SO3, SO2 2) оксиды d-элементов в высшей с.о.: CrO3, Mn2O7 |
|
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
K2O + H2O = 2KOH
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
CuO + H2 = Cu + H2O
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
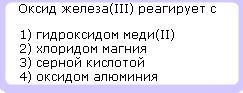
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
Ответ: 3)
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
N2O3 + H2O = 2HNO2
1. + O2
если элемент, образующий оксид в средней с.о.:
2SO2 + O2 = 2SO3
2. + H2
восстановление до несолеобразующего оксида или простого вещества:
CO2 + H2 = CO + H2O
SO2 + H2 = S + H2O
3. + вещества. образованные металлами:
SO2 + 2Ca = 2CaO + S
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + H2O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
N2O + O2 = N2O3
CO + H2 = C + H2O
Ответ: 3)