Периодический закон и периодическая система
Вопрос А2 ГИА по химии —
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Задания в целом несложные, все, что необходимо знать, это изменение свойств элементов:
- слева направо ( от первой к седьмой группе) в периодах : неметаллические (окислительные) свойства усиливаются, т.к. радиус атома становится все меньше, а количество электронов увеличивается;
- сверху вниз в группах усиливается способность отдавать электроны, т.е. металлические (восстановительные) свойства, т.к. радиус увеличивается.
свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений
находятся в периодической зависимости от величины зарядов ядер их атомов
1 вариант — ряд элементов
1) K-Na-Li — расположены в одной группе, снизу вверх, значит, металлические свойства уменьшаются;
2) аналогично;
3) С-Si-Ge — сверху вниз идет усиление восстановительных свойств — углерод C может быть типичным неметаллом, кремний Si проявляет уже более ярко выраженные свойства ; германий Ge — полупроводник
4) Al-Si-C — вправо и наверх — совсем не подходит
Ответ: 3)
2 вариант — сравнение двух элементов
1) азот (N) расположен выше фосфора (P), неметаллические свойства фосфора слабее;
2) кислород (O) расположен правее и выше фосфора (P), так что неметаллические свойства фосфора слабее;
3) сера (S) находится правее, значит, фосфор «металличнее»;
4) кремний (Si) — расположен в том же периоде, но левее, значит, неметаллические свойства у фосфора будут сильнее.
Ответ: 4)
3 вариант — свойства сложных веществ
Свойства веществ, образованных элементами так же периодичны. Только термины немного поменялись:
- оксид, образованный металлом — основной
- Al2O3, B2O3, ZnO, Cr2O3, Fe2O3 — амфотерные
- оксиды, образованные неметаллом в высшей с.о. — кислотные
1) CaO — основной, SO3 — кислотный
2) Na2O — основной, Al2O3 — амфотерный
3) CO2 — кислотный, Al2O3 — амфотерный, MgO — основной
4) все кислотные
Ответ: 3)
4 вариант — вопросы про характеристику элемента в периодической системе
Валентность элемента в высшем оксиде равна номеру группы, в которой располагается элемент:
1) 2 -3 -4
2) все во II группе
3) все в VII
4) все в I
Ответ: 1)
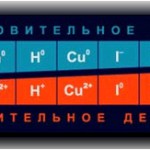
В водородных соединениях (гидридах) элементы проявляют минимальную (низшую) степень окисления.
- I — III группы минимальная с.о. = № группы
- IV-VII — № группы-8
1) минимальная с.о. = -4
2) -1, -2 и -3
3) -3, -2, -1
4) -3
Ответ: 4)
Повторим:
В периодах (с увеличением порядкового номера)
увеличивается заряд ядра,увеличивается число внешних электронов,
уменьшается радиус атомов,
увеличивается прочность связи электронов с ядром (энергия ионизации),
увеличивается электроотрицательность,
усиливаются окислительные свойства простых веществ («неметалличность»),
ослабевают восстановительные свойства простых веществ («металличность»),
ослабевает основный характер гидроксидов и соответствующих оксидов,
возрастает кислотный характер гидроксидов и соответствующих оксидов.
В группах (с увеличением порядкового номера)
увеличивается заряд ядра,
увеличивается радиус атомов (только в А-группах),
уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
уменьшается электроотрицательность (только в А-группах),
ослабевают окислительные свойства простых веществ («неметалличность»; только в А-группах),
усиливаются восстановительные свойства простых веществ («металличность»; только в А-группах),
возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).







периодический закон и периодическая система
В водородных соединениях (гидридах) элементы проявляют минимальную (низшую) степень окисления.
I — III группы минимальная с.о. = № группы
IV-VII — № группы-8
1) минимальная с.о. = -4
2) -1, -2 и -3
3) -3, -2, -1
4) -3
Ответ: 4) Или все таки 3?
напишите какой вопрос. Минимальная с.о. чего?