Закономерности изменения химических свойств элементов и их соединений
Закономерности изменения свойств химических
элементов и их соединений
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.
Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
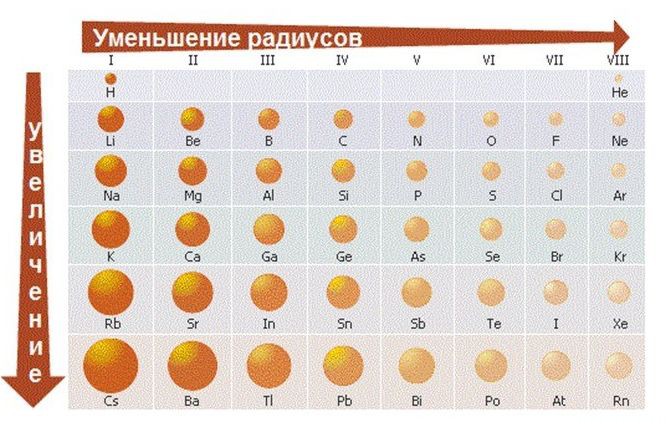
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
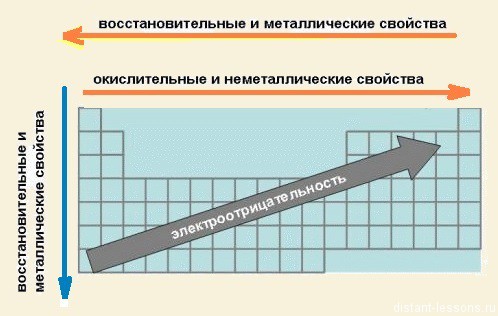
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений
Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.



В информации ничего лишнего, все четко, ясно и понятно. СПАСИБО)))
Лолита Витальевна, я снова к Вам со своими вопросами:-) Я читала, что уменьшение окислительных свойств с увеличением радиуса характерно не только для атомов, но и для ионов. А можно ли такое правило применить, скажем, к оксидам? Например, радиус оксида серы (IV) меньше, чем оксида серы (VI). Можно ли сказать, что первый будет более сильным окислителем, чем второй?
Доброго времени суток!
Немного не поняла вопрос — у оксидов cеры IV и VI радиус серы одинаковый…
Хм, наверное, я не слишком удачный пример привела… А вот оксиды NO и N2O3 будут иметь разные радиусы или нет. По картинкам, вроде бы да. Если так, то как эти радиусы будут влиять на их окислительные свойства? Понятно, что на окислительные свойства значительнее влияет степень окисления, но мне бы хотелось понять и другие факторы.
Вы имеете в виду размер молекул? Не думаю, что здесь есть прямая связь — самые сильные окислители — перманганат, бихромат и т.д. — немаленького размера молекулы…
Я всё поняла. Да, я имела в виду размер молекул:) Радиусы оксидов серы действительно одинаковые: длины S=O связей-то равны.
Спасибо Вам за такие подробные ответы и замечательный сайт!
И вам спасибо за добрый отзыв! Будут вопросы — пишите — все разберем! 🙂
Здравствуйте! У вас в 3 ворпосе теста подходят 2 ответа: кальций 2+ и калий +
Может быть, это я что-то не поняла? Объясните, пожалуйста. Спасибо)
Да, там ошибка в тесте — должно было быть Са(0). Спасибо, что заметили, исправим! 🙂
Здравствуйте Лолита.хотела спросить у вас есть видео для подготовки к ЕГЭ по химии.
Добрый день!
Есть, но пока не выложены на сайт. Их еще доработать надо…
Здравствуйте . Как изменяются электронные конфигурации р- элементов 3 группы? Спасибо заранее.
Добрый день! вот темы по вашему вопросу:
— электронное строение p-элементов 2-го периода http://distant-lessons.ru/ximiya/elektronnaya-konfiguraciya-atoma/stroenie-elektronnyx-obolochek-atomov-r-elementov
— электронное строение p-элементов 3-го и следующих периодов http://distant-lessons.ru/ximiya/elektronnaya-konfiguraciya-atoma/stroenie-elektronnyx-obolochek-atomov-r-elementov-2
Здравствуйте, объясните пожалуйста,я не понимаю как определять, то есть надо выбирать там, где степень окисления возрастает??( меня путает то, что ионы одинаковы в ряду и я не знаю как определить )
В каком ряду кислотность соединений возрастает.
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
Добрый день! Все просто: чем выше у элемента степень окисления, тем более кислотные свойства у его соединения:
в 1) у хрома степень окисления возрастает от 0 (типичный металл, до +3 — амфотерный и +6 (кислотный)
В других вариантах степень окисления уменьшается
Хорошо)) А следовательно чем меньше степень окисления у элемента , тем более основные свойства у его соединения?
у d — элементов — да
Спасибо Вам большое за помощь)
🙂 рада, что смогла помочь! Пишите, если будут еще вопросы
Здравствуйте. Как посмотреть где я ошиблась?
когда заканчиваете тест, там внизу должны показаться ответы
Здравствуйте, подскажите пожалуйста есть ли у вас тема Строение электронный оболочек атомов
Добрый день! Есть конечно! Смотрите тему Электронная конфигурация атомов:
Строение электронных оболочек атомов s-элементов
электронное строение p-элементов 2-го периода
электронное строение p-элементов 3-го и следующих периодов
d-элементы