Свойства кислот и оснований
Вопрос А11 ГИА (ОГЭ) по химии —
Химические свойства оснований. Химические свойства кислот
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Искл. — NH4OH — основание, но образовано не металлом
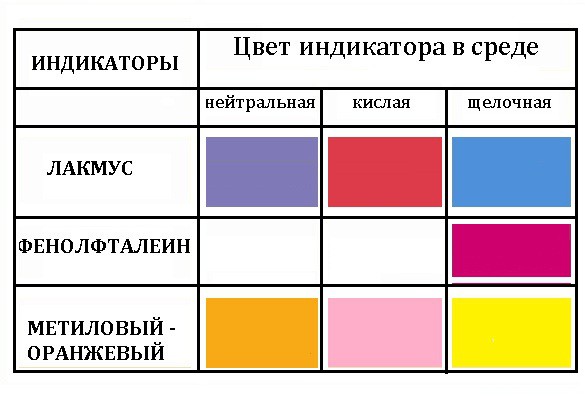
1. Изменение окраски индикатора:
2. Взаимодействие кислот с металлами:
металлы, находящиеся в ряду напряженийДО водорода (Н) —
- образуют соль и водород:
Na + H2SO4 = Na2SO4 + H2↑
металлы в ряду напряжений ПОСЛЕ водорода (Н)
- не реагируют с бескислородными кислотами, с кислотами-окислителями реагируют, но не оразуют водород:
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
- Al и Cr пассивируются концентрированным кислотами, реагируют с ними только при нагревании, но олегко взаимодействют с разбавленными:
2Al + 3H2SO4 (разб) -> Al2(SO4)3 + 3H2
3. Все кислоты взаимодействуют со всеми основными оксидами:
Ag2O + 2HNO2 -> 2AgNO2 + H2O
4. Все кислоты взаимодействуют с основаниями, образуя соль и воду:
H2SO4 + 2LiOH = Li2SO4 + 2H2O
5. Соль+ кислота: реакция идет при условии, что образуется слабая кислота:
Na2S + 2HCl -> 2NaCl + H2S
Ответ: 4)
Свойства оснований
По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания
1. Многие гидроксиды металлов разлагаются на соответствующие оксиды и воду:
2Fe(OH)3 -> Fe2O3 + 3H2O
2. Гидроксиды щелочных и щелочно-земельных металлов реагируют с хлором с образованием двух солей:
6KOH (горяч) + 3Cl2 -> KCLO3 + 5KCl + 3H2O
2KOH (холодн) + Cl2 -> KCl + KClO + H2O
3. Реакции с амфотерными металлами:
2NaOH + 6H2O + Al -> 2NaAl(OH)4 + 3H2
(При сплавлении: 2Al + 2NaOH + 2H2O -> 2NaAlО2 + 3H2)
4. С кислотными оксидами:
Ba(OH)2 + SO3 = BaSO4 + H2O
5. «Классика» — основание + кислота:
LiOH + HNO3 = LiNO3 + H2O
6. Соль + основание: реакция идет, если образуется слабое ( тлт нерастворимое) основание:
CuCl2 + 2NaOH -> Cu(OH)2 + 2NaCl
Ответ: 2) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
7. Все растворимые неорганические кислоты реагируют с аммиаком: (донорно-акцепторный механизм)
2NH3 + H2SO4 -> (NH4)2SO4
Ответ: 4) кислоты с кислотными оксидами не реагируют
Для тренировки:
В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
В реакцию с соляной кислотой вступает 1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
Разбавленная азотная кислота может реагировать с каждым из веществ:1) Mg и Mg(OH)2
2) Fe и FeCl3
3) H2 и O2
4) CO2 и SO2
Раствор гидроксида калия может реагировать с каждым из веществ:1) N2 и NO2
2) C и CO2
3) Cu и CuO
4) SO2 и H2SO4
Карбонат калия образуется при взаимодействии гидроксида калия с1) CO2
2) Na2CO3
3) CaCO3
4) (Cu(OH))2CO3
Хлорид меди(II) образуется при взаимодействии соляной кислоты с1) Cu(OH)2
2) Cu(NO3)2
3) Cu
4) Cu2O
Углекислый газ выделяется из раствора карбоната натрия под действием1) Ca
2) NaOH
3) H2
4) H2SO4
Аммиак выделяется из раствора хлорида аммония под действием1) HBr
2) H2
3) AgNO3
4) KOH
Азотная кислота вступает в окислительно-восстановительную реакцию с1) Cu(OH)2
2) CuO
3) CuCO3
4) Cu
Соляная кислота вступает в окислительно-восстановительную реакцию с1) MgCO3
2) Mg(OH)2
3) MgO
4) Mg
Газ выделяется при действии концентрированной азотной кислоты на1) Cu
2) CuO
3) MgSO4
4) Mg(OH)2
Водород выделяется из серной кислоты под действием1) Cu
2) Al
3) Al2O3
4) Cu(OH)2
В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния