Серная кислота химические свойства
Серная кислота химические свойства
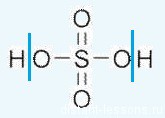
Формула серной кислоты — H2SO4
 Очень сильная кислота, к тому же это кислота-окислительь.
Очень сильная кислота, к тому же это кислота-окислительь.
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
- М (металл до водорода) + H2SO4 = соль и выделение водорода: 2Na + H2SO4 = Na2SO4 + H2↑
- Основной оксид+ H2SO4 = соль + вода: MgO + H2SO4 = MgSO4 + H2O
- Основание+ H2SO4 = соль + вода: 2NaOH + H2SO4 = Na2SO4 + 2H2O
Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
- С металлами — окисляет металл, сама восстанавливается до SO2:
Сu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O - C неметаллами:
S + 2H2SO4(конц) = 3SO2 + 2H2O; - С оксидами неметаллов:
СO + H2SO4 = CO2 + SO2 + H2O - C кислотами — неокислителями:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
Серная кислота и вода

C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
- Средние: все атомы водорода замещены на металл: Na2SO4
- Кислые: от кислоты остался один водород: NaHSO4 — гидросульфат натрия.
Переход средняя соль —-> кислая соль:
Na2SO4 + H2SO4 = 2NaHSO4
Переход кислая соль —->средняя соль:
2NaHSO4 = (t) = Na2SO4 + H2SO4
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.