Схема окислительно восстановительной реакции
Окислительно-восстановительные реакции (овр) — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Схема окислительно восстановительной реакции
Любое взаимодействие атомов — это отдача — принятие электронов.
Когда нам дано какое-то уравнение реакции и нужно его уравнять, т.е.
написать схему окислительно восстановительной реакции,
нужно сначала:
определить степени окисления элементов, участвующих в процессе овр.
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Степень окисления — формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
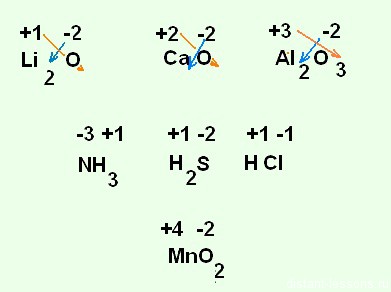
Алгоритм определения степени окисления (с.о.):
- некоторые элементы имеют степень окисления, которую принимаем за константу:
у водорода H с.о. = +1 (кроме гидридов: LiH — c.о.(Li) = +1, с.о.(H)=-1);
у кислорода O с.о. = -2 (кроме фторида кислорода: OF<sub2 — c.о.(O)=+2 и H2O2 — c.о.(O) = -1)
- у всех металлов главных групп периодической системы с I по III группы степень окисления всегда +1, у элементов II группы — +2, III — +3
- в сложных веществах (больше 2-х элементов) с.о. элемента определяется по другим элементам, но при обязательном условии:
в целом молекула электронейтральна 0, т.е. в сумме все с.о. должны дать 0:
Такие задания есть даже в ЕГЭ — даны примеры веществ и нужно определить где, например, степень окисления элемента максимальна. Очень рекомендую определять ее не в уме, а по такому нехитрому уравнению — тогда точно не будет ошибки.
Теперь определяем — какие элементы буду участниками овр — смотрим изменения степеней окисления:
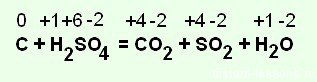 <\center>
<\center>Итак, степень окисления поменяли:
- углерод — с 0 до +4 — окислился;
- сера — с +6 → +4 — восстановилась.
Составляем саму схему окислительно восстановительной реакции:
С0 -4e— → C+4 — окисление, углерод — восстановитель;
Повышение заряда — окисление, сам элемент при этом будет восстановителем.
Понижение — восстановление, элемент — окислитель
S+6 +2e— → S+4 — восстановление, сера — окислитель
В любой реакции
количество отданных электронов должно быть равно количеству принятых:
1• | С0 -4e— → C+4
2• | S+6 +2e— → S+4
Складываем оба уравнения — реагенты с реагентами, продукты — с продуктами, с учетом коэффициентов и получаем:
С + 2H2SO4= CO2 + 2SO2 + 2H2O
Но это самая база, самые основы, без которых невозможно научиться уравнивать более сложные окислительно-восстановительные реакции.
Для того, чтобы уметь СОСТАВЛЯТЬ окислительно-восстановительные реакции, нужно знать все важнейшие окислители и восстановители и знать их свойства.








Лолита,здравствуйте! С удовольствием сообщаю Вам, что Ваш сайт удостоился награды «Кубок признания»! Мне очень нравиться Ваш ресурс, здесь уютно и всегда приятно находиться! Заходите забирайте Вашу награду по ссылочке: http://moypevenec.ru/kubok-priznaniya/ Поздравляю!
Извините, но на вашем сайте впрочем как и везде, очень мало примеров ОВР
Этого крайне не достаточно для решения С1 на ЕГЭ, сами попробуйте.. ну или тест проведите результат на лицо.
Для решения ОВР нужно руку набить, а эти слюнявые 2-3 примера ничему не научат, да и где важнейшие окислители и востановители…
Короче, прошу привести тему в идеальное положения. Большое спасибо. mail не верен, т . к нет у меня его! Буду заходить проверять. Спасибо большое, удачи!!!
Эльдар, чтобы хоть чему-то научиться, нужно «руку набить» 🙂 Когда я провожу занятия с детьми, то мы прорешиваем вместе порядка 100 овр. Если вам лично нужны примеры реакций, могу прислать ) но для этого надо знать куда. Много примеров ОВР с решениями в разделе — курс ЕГЭ с примерами (он платный)
Лолита, а если такое уравнение: H2S+KMnO4+H2SO4=S+MnSO4+K2SO4+H2O
у меня получилось что в одном случае сера окислилась, а в двух других восстановилась. такое возможно?
Елена, в данном конкретном случае сера у вас окислилась с -2 до 0, а марганец восстановился.
H2SO4 здесь выступает как среда реакции
Вы приведите другие примеры — а то не очень конкретно получается :))
Лолита, спасибо за ответ.
Марганец восстановился с 7 до 1. верно?
Еще задача, не могу победить ее, помогите:
Вычислить объем газа, образованного при норм условиях при взаимодействии 100 гр карбоната калия и раствора,содержащего 100 гр серной кислоты.
Заранее вас благодарю.
Нет, Mn восстановился до +2
А задача ОЧЕНЬ легкая 🙂
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
n(CaCO3)=m\Mr
n(H2SO4) = m\Mr
по меньшему количеству моль определяем n(CO2)
V=n*22.4 л\моль
n(K2CO3-карбонат калия)=0,72 моль,
n(H2SO4) = 1.28 моль,
наименьшее 0,72, тогда объем равен 16,128 литров. Верно?
Да. верно. На сайте есть тема про задачи на избыток и недостаток — посмотрите