Задачи на фенолы
Задачи на фенолы
Фенолы отличаются от алифатических спиртов наличием бензольного кольца и исключительно кислотными свойствами -OH — группы (т.е. отщепляется только водород).
Задачи на фенолы пример №1
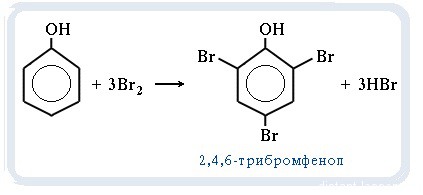
Внимание: с бромной водой будет реагировать только фенол (качественная реакция) !
С6H5-OH + Br2 = C6H4Br(OH) + HBr
Т.е. выпавший осадок массой 33.1 г — 2,4,6-бромфенол.
n(C6H2Br3(OH))=m\Mr=33.1\331 = 0.1 моль
n(C6H5OH)=n(C6H2Br3(OH))= 0.1 моль
m(C6H5OH)=n*Mr = 0.1*94=9.4 г
Значит, масса ароматического углеводорода m = m(cмеси) — m(C6H5OH) = 14-9.4 = 4,6 г
Mr(CnH2n-6)= m\n=4,6 \ 0.05 = 92
Подставляем значение молярной массы в общую формулу аренов:
12n + 2n -6 = 92
14n=98
n=7
C7H8 — толуол
Задачи на фенолы пример №2
|
При обработке 4,18 г смеси бензилового спирта, крезола и фенола избытком калия выделилось 448 мл (н.у.) газа. Вычислите массовую долю фенола в исходной смеси.
|
Итак, сначала определимся с формулами:
бензиловый спирт: С6H5CH2OH:
крезол: С6H4(CH3)OH
фенол: С6H5OH:
Бензиловый спирт С6Н5СН2ОН и крезол СН3С6Н4ОН являются изомерами состава С7Н8О. Их массу в смеси обозначим через х, а объем выделившегося водорода – у, тогда реакцию изомеров с калием можно записать одним уравнением:
2C7H7OH + 2K = 2C7H7OK + H2
В реакции фенола с калием масса фенола (4,18 – х) г, а объем выделившегося водорода
V(Н2) = z л.
2С6H5OH+2K=2C6H5OK+H2
Всего в реакциях выделилось 0,448 л газа: у + z = 0,448 л,
22,4х/(2*108) + 22,4*(4,18 – х)/(2*94) = 0,448.
Отсюда х = 3,24 г.
Масса фенола равна: 4,18 – 3,24 = 0,94 г.
Массовая доля фенола в смеси:
w(С6Н5ОН) = 0,94/4,18 = 0,225, или 22,5%.
Далее считаем сколько водорода выделилось при реакции с фенолом и по разности находим объем водорода выделяемый смесью бензилового спирта и крезола массой 3,24 г. Составляем еще одну систему уравнений.
_______________________________________________________________________________________________________________
Как видите, все задачи на фенолы сводятся к отличительным особенностям их химических свойств.