Относительная плотность по… задачи
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
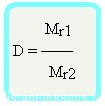
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 г\моль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 г\моль • D (обратите внимание, Mr(воздуха) принята равной 29 г\моль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 г\моль • D
Mr(вещества)=29 г\моль • 1.448 = 42 г\моль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 г\моль · 0.8571=36 г\моль
x=Mr(Cx)\Ar(C)=36 г\моль ÷ 12 г\моль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 г\моль · 0.1429=6 г\моль
x=Mr(Hy)\Ar(H)=6 г\моль ÷ 1 г\моль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 г\моль ·1.05=42 г\моль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y\2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V\22,4 л\моль = 33.6\22.4=1.5
n(H2O)=m\Mr=27\18=1.5
Соотношение х : y\2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5







Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 г\моль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 г\моль
и, наконец,
4) D = Mr (( С5H10Br2 ) \ Mr(O2) = 230\32 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз 🙂 ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! 🙂
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 г\моль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99г\моль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 г\моль — получаем либо кремний: SiCl4 \SiBr4, либо галогеналкен: C2Cl4 \С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=m\Mr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=m\n=12\0.15 = 80 г\моль
Ar(Me)=(80-48)\2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=m\Mr=413.2\44 = 9.4 моль
n(оксида)=n(CO2)
Mr=m\n = … не получается
Проверьте условие задачи. Что-то там не то с числами…
Объясните пожалуйста, почему уравнение реакции CxHy+O2 = !xCO2 + !y/H2O
меня интересуют места, где х и у. Спасибо!
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y\2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Добрый день!
составляем уравнение горения:
CxHyOz + O2 -> xCO2 + y\2H2O
по относительной плотности находим M( вещества) = 2.6875*32 г\моль =86 г\моль
n ( вещества ) = m\M = 8.6 u\86 г\моль = 0.1 моль
n(CO2) = V\Vм = 13.44 л\22.4 л\моль = 0.6 моль
n(H2O = m\M = 12.6 г \ 18 г\моль = 0.7 моль
получаем соотношения: 1: х как 0.1 к 0.6 => х=6
1: y\2 как 0.1 к 0.7 y=14
C6H14
Здравствуйте!стыдно признаться,но я как в школе не понимала химию,так я не понимаю ее и сейчас когда учится сын и помочь совсем не могу.Может Вы поможете: Вычислите относительную плотность по воздуху и водороду для газов: метан (CH4), углекислый газ (CO2). Спасибо Вам огромное заранее!
Относительная плотность вещества по воздуху = M(вещества) \ M(воздуха) (29 г\моль)
Относительная плотность вещества по водороду = M(вещества) \ M(H2)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. (Ответ: С3Н8.)
Здравствуйте! Помогите оформить , пожалуйста очень срочно нужно
M(вещества)=M(N2)*D=28г\моль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)\12 г\моль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан 🙂
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
мнда….
Это учитель вам дал такие формулировки?
1) если вы имеете в виду плотность оксида углерода (IV)по азоту, то это M(CO2)\M(N2)/ Молярные массы веществ находите в периодической системе
2) если нужно найти молярную массу газа с плотностью по водороду 32, то M = 32*2 г\моль
3) плотность пропана по воздуху? Кстати, формула пропана — C3H8…. 44 г\моль \ 29 г\моль . Если все же вам дано вещество C3H3? то разделите его молярную массу на 29
4) CO2 например
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 г\моль = 42 г\моль
M(Hy)=42 г\моль* 0.143 = 6 г\моль
y = M(Hy)\Ar(H) = 6\6 = 1
значит, M(Cy)=42-6 = 36 г\моль
y = M(Cy)\Ar(C) = 36\12 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
32*Х + 48*(1-Х) = 36
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 г\моль = 28 г\моль, предположим, что в оксиде 1 атом О, тогда 12 г\моль — атомная масса элемента. Это С
M( оксида 2) = 15*2 г\моль = 30 г\моль. Если у нас 1 атома О, то 14 г\моль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 г\моль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси