Смещение химического равновесия
В части А ЕГЭ по химии есть задания на тему смещения химического равновесия. Это довольно простая тема обратимости химических реакций и укладывается буквально в три примера.
Смещение химического равновесия
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации, температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
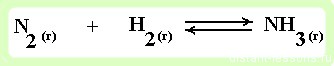
пример 1
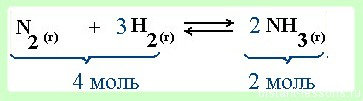
реакция образования аммиака — протекает в газовой среде
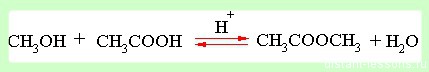
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
- Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
- Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
- Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:
- Эндотермические реакции — реакции, протекающие с поглощением теплоты.
-
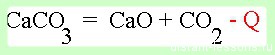
Экзотермические реакции — протекают с выделением теплоты.
Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе:
в эндотермической реакции:
- увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
- уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
- увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
- уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции);
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде.
- При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
- При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества, например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается.
Если объем (количество веществ) смеси не меняется, то изменение давления не будет оказывать влияние на смещение химического равновесия.
Катализаторы не влияют на смещение химического равновесия!
- В ЕГЭ это вопрос А21 — Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
[TESTME 58]
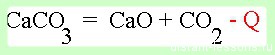




Добрый день, подскажите пожалуйста, куда сместиться равновесие обратимой реакции при увеличении концентраций всех веществ в 3 раза.
Добрый день!
Это зависит от самой реакции — какие вещества, в каком соотношении реагируют… напишите реакцию, посмотрим!
Здравствуйте! Еще можно задать вопрос?:-)
В 5 вопросе: не понятно, почему правильным ответом считается ответ 2. Ведь объем реагентов больше объема продуктов, а значит, изменение давления будет влиять на смещение равновесия.
В вопросе 8: как это — увеличение площади поверхности цинка не влияет на смещение равновесия? Чем больше площадь твердого реагента, тем быстрее идет реакция!
С уважением.
Добрый день! Да, вы правы — в тесте ошибка вкралась. Исправили.
А вот про увеличение площади поверхности цинка — сами подумайте — равновесие и скорость — это же разные вещи, правда? 😉
Почему в ионнообменных реакциях равновесие смещается именно в сторону образования осадков, газов и слабых электролитов? Например, MgCl2+NaOH=Mg(OH)2↓+NaCl
Добрый день! Каждая реакция должна быть энергетически выгодна. Расчет идет по изменению энтропии. Оказалось, что выгодными являются те реакции, которые идут с образованием осадка, газа или малодиссоциирующего вещества