Электролитическая диссоциация веществ
Все вещества делятся на те, которые проводят электрический ток и те, которые не проводят, проще говоря, на электролиты и неэлектролиты.
Электролитическая диссоциация веществ
Электролиты — вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток.
Неэлектролиты — вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят.
|
Электролиты |
Неэлектролиты |
|
|
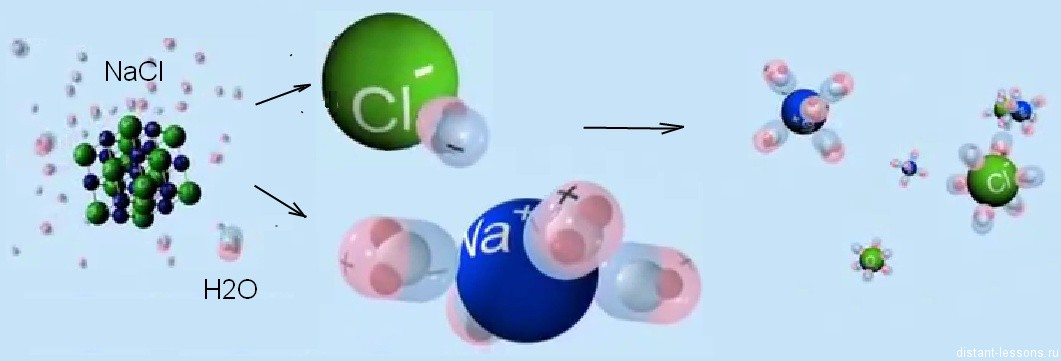
Распад электролитов на ионы при растворении их в воде называется
электролитической диссоциацией.
Как происходит электролитическая диссоциация веществ?
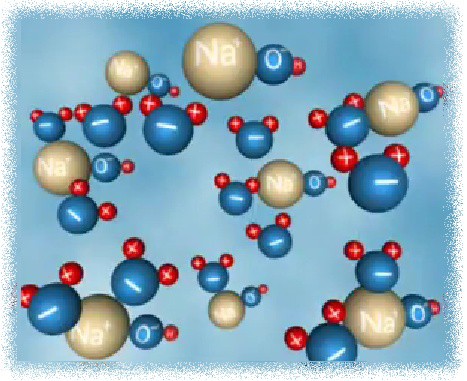
Молекулы воды полярны.
Когда в воду попадает вещество, само имеющее положительные и отрицательные заряды, то между зарядами вещества и водой возникают силы притяжения .
Притяжение между зарядами внутри кристаллической решетки ослабевает.
Эти заряды переходят в раствор в виде гидратированных ионов, частиц, связанных с молекулами воды.
Электролитическая диссоциация веществ — процесс обратимый,
в растворах электролитов наряду с их ионами присутствуют и молекулы.
Поэтому растворы электролитов характеризуются степенью диссоциации.
Степень диссоциации — это отношение числа распавшихся на ионы молекул N’ к общему числу растворенных молекул N:
- если количество ионов больше, то α близка к 1 — ионов в растворе больше, чем молекул — значит, вещество — сильный электролит;
- если молекул больше, чем ионов, значит, вещество неохотно диссоциирует — слабый электролит.
|
слабые электролиты |
|
|
1) кислоты:
(сильная кислота — сильный электролит) 2) основания: все растворимые в воде, например, NaOH 3) соли — растворимые в воде |
1) вода H2O 2) кислоты: все органические кислоты;
3) основания: NH4OH, мало-и нерастворимые основания 4) мало- и нерастворимые соли, соли органических кислот |
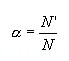




Добрый день! Степень диссоциации для сильных электролитов близка к 1, т.е. почти все молекулы диссоциируют на ионы. Почему в тексте написано, что для сильных электролитов степень диссоциации >1?
Это опечатка, спасибо, что указали!
Здравствуйте Лолита, это снова я:-) Вы пишите, что малорастворимы основания являются слабыми электролитами. Но как же, например, гидроксид кальция — малорастворимое основание, но при этом почти полностью диссоциирующее, что подтверждает щелочная реакция его раствора.
Вообще с гидроксидом кальция странная ситуация. У одних авторов он щёлочь, у других — нет. Видимо, это связано с тем, что в большинстве учебников «щёлочь — хорошо растворимое основание». Но мне кажется, что правильнее будет «сильное основание = сильный электролит = щёлочь».
Доброго времени суток, Ольга!
Понимаете, фраза «малорастворимое основание, но при этом почти полностью диссоциирующее» — противоречит сама себе.
Среда раствора может быть сильно-, а может быть и слабощелочная.
Гидроксид кальция — Сa(OH)2- малорастоврим — K2 = 4,3·10-2
Гидроксид цинка — Zn(OH)2 — нерастворим — K2 = 4,0·10-5
Гидроксид лития K2 = 6,75·10-1
В случае анализа силы электролитов тоже есть количественные показатели — это ток, проходящий через растовр, и у гидроксида кальция она меньше, чем у растворимых оснований.
А в интернете много разной противоречивой информации.
Чтобы самой определиться — смотрите справочники.
Я имела в виду, что диссоциирует та часть вещества, которая переходит в раствор.
Получается, что гидроксид кальция это всё-таки не щелочь?
Везде по-разному (в интернете) написано. В моей химической энциклопедии написано, что он «Плохо растворяется в воде».
определение щелочи — «к щёлочам относят хорошо растворимые в воде основания»…
Понятно, спасибо!
Проверьте почту — там должно быть письмо с сайта