Подгруппа кислорода
Подгруппа кислорода
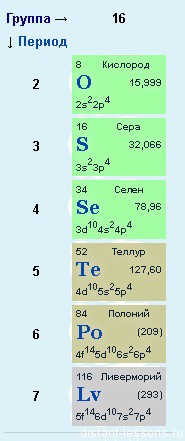
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4
Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.
Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), +2 (редко), +4, +6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства
 Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S + O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства |
Восстановительные свойства |
|
Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
| Окислительные свойства |
Восстановительные свойства |
|
|
Cернистая кислота — H2SO3 (степень окисления серы= +4). Соли — сульфиты
Серная кислота — H2SO4 (cтепень окисления серы=+6). Соли — сульфаты
Их свойства мы рассмотрим отдельно.
[TESTME 32]

Лолита Витальевна, добрый день! А при какой температуре кислород переходит в жидкое состояние? И у вас ошибка » Обычно сера — плстическое вещество»
-182,97° С, 90,19 К
Ошибку исправили, спасибо, что обратили внимание! 🙂