Азотная кислота химические свойства
Азотная кислота
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
4HNO3 = 4NO2 + 2H2O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
Почему? Да потому что азот N проявляет в этом соединении степень окисления +5, что соответствует номеру его группы. Т.е. сам азот N может только понизит свою степень окисления — восстановиться. Значит, по химическим свойствам азотная кислота — сильный окислитель.
S + HNO3 = NO2 + SO2 + H2O
окислитель N(+5) +1e(-) = N(+4) — восстановление
восстановитель S(0) -4e(-) =S(+4) — окисление
S +4 HNO3 = 4NO2 + SO2 + 2H2O
Это просто один из примеров таких реакций. Продукт реакции — оксид азота (IV) — NO2, не единственно возможный, есть еще варианты, и их образование подчиняется определенным правилам.
Химические свойства азотной кислоты
Правила взаимодействия азотной кислоты и металлов
1 правило — правило концентрации
Концентрированная азотная кислота восстанавливается до оксида азота (IV) — NO2
Zn + 4HNO3 (конц) = Zn(NO3)2 + 2NO2 + 2H2O
Разбавленная азотная кислота восстанавливается до оксида азота (II) — NO
3Zn + 8HNO3 (разб) = 3Zn(NO3)2 + 2NO + 4H2O
2 правило — правило металла
Смотрим ряд активности металлов!
- С золотом (Au) и платиной (Pt)азотная кислота не реагирует ни при каких условиях.
- Азотная кислота и металлы, стоящие в ряду напряжений после водорода — применимо правило 1 — правило концентрации:
Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4H2O - Азотная кислота и металлы, стоящие в ряду напряжений до водорода: вариантов продуктов немало, есть закономерность:
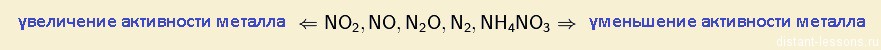
Все реакции азотной кислоты — окислителя ( с металлами и неметаллами) изучаем ЗДЕСЬ!
Соли азотной кислоты
(нитраты)
Здесь мы рассмотрим вопрос реакций разложения нитратов
-
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
2KNO3 = 2KNO2 + O2
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
-
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
2Сu(NO3)2 = 2CuO + 4NO2 + O2
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
-
- Разложение нитратов металлов правее ртути — до металла:
2AgNO3 =2 Ag + 2NO2 + O2
- Разложение нитратов металлов правее ртути — до металла:
- Нитрат аммония разлагается до образования оксида азота(I) — N2O:
NH4NO3 = N2O + 2H2O
На нитрат-ионы NO3(-) нет качественных реакций — все соли азотной кислоты очень хорошо растворимы в воде.





Добрый день! Помогите, пожалуйста. Никак не могу разобраться, при взаимодействии с разбавленной азотной кислотой какого металла образуется N2; NH3? Буду вам признательна, если поможете))
NH3 не образуется, образуется NH4NO3 — с щелочными металлами,
N2 образуется при взаимодействии с Mg, Al, Zn
Спасибо большое!Хороших Вам новогодних каникул!
С Новым Годом! Пусть исполнятся все мечты! 🙂