Химические свойства галогенов
Химические свойства галогенов
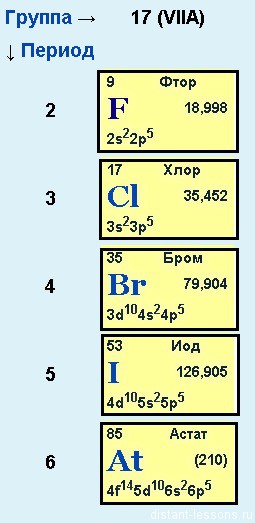
или подгруппа фтора
Фтор, хлор, бром, йод и астат
Общее электронное строение:
nS2 np5
И, как всегда, все не так просто, как хотелось бы…
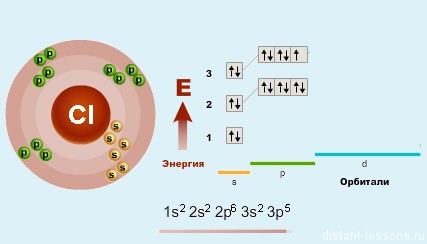
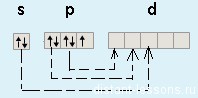
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (!!!) возможны степени окисления +1, +3, +5 и +7.
Итак, выводы:
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.;
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ;

- Хлор Cl2 — желто-зеленый газ;
- Бром — Br2 — бурая жидкость;
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
1. Взаимодействие с водородом:
F2 + H2 = 2HF — плавиковая кислота
2. Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды)
3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
4.Окислительный свойства:
Сl2 + H2S = S + 2HCl
5. Взаимодействие с водой:
раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
[TESTME 34]

8. В соединении OF2 степень окисления кислорода:
+2
-2
0
-1
я ответила «1», а он правильным ответом выдал «2»
разве это правильно?
Конечно, у кислорода будет степень окисления +2, т.к. у фтора ВСЕГДА -1 — из-за его электронного строения.
Сверху вниз ослабевают окислительные свойства, а сила кислот в ряду HF – HCl – HBr – HI возрастает, что объясняется уменьшением в этом же направлении энергии связи и увеличением межъядерного расстояния. Или я чего-то не понимаю? Вопрос о силе кислот встречается давольно часто, кто-то может не правильно истолковать ваши слова.
Да, все правильно. Сила кислот — это «легкость » отдачи водорода, те. величина диссоциации — разрыва связи H-Элемент. Чем радиус больше, тем легче связь рвется, поэтому в группе сверху вниз сила кислот HЭ возрастает
Извините, но тогда я не понимаю, почему у вас выделен текст «сила кислот сверху вниз ослабевает»
Опечатка. Спасибо, что обратили внимание. Исправили