s-элементы
Чтобы рассмотреть строение электронных оболочек атомов элементов, нам надо понимать строение атома и периодическую систему.
Допустим, что с этим мы разобрались.
Теперь подробно рассмотрим строение электронных оболочек атомов
S-элементов
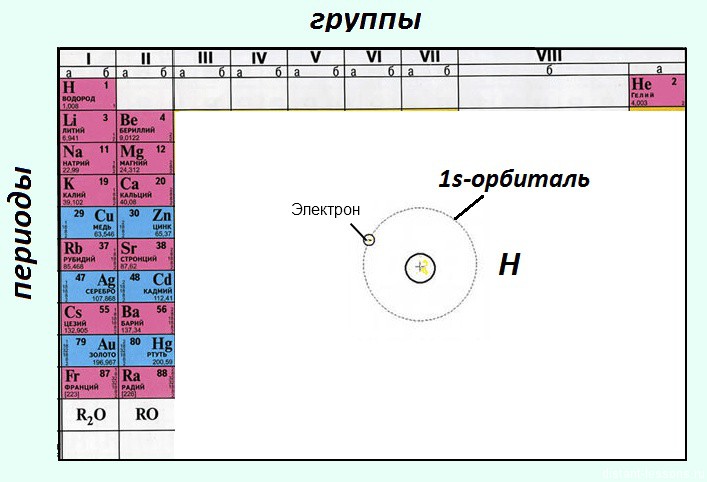 В школьной периодической системе элементов они обозначены красным цветом — «красненькие«.
В школьной периодической системе элементов они обозначены красным цветом — «красненькие«.
Помимо этого, это элементы главных подгрупп, т.е. электроны s-орбитали у них валентные
А что следует из того, что у элемента электроны располагаются на S-орбитали?
- Каждый энергетический уровень атома начинается с этой орбитали. Это значит, что если у атома появится возможность отдать электроны с этого уровня, он приблизится к стабильному состоянию — достижению 8-ми электронной оболочки, как у благородных газов!
(у гелия, например, s-обиталь полностью заполнена электронами (2 электрона), он химически инертен) - Значит, в основном, S-элементы проявляют металлические свойства — восстановительные
- На нем могут располагаться максимум 2 электрона! Т.е. их валентность равна 1 или 2
s- элементы
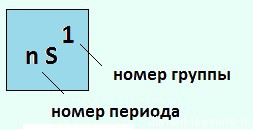
Как видно из рисунка, элементы 1-й группы периодической системы имеют на внешнем энергетическом уровне только 1 электрон, поэтому их валентность=1 , степень окисления — +1.
Внизу таблички есть подсказка: формула высшего оксида:
+1 -2
R2O
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
Если расписать строение подробно, например, для K, то вот «полный отчет»:

s- элементы
2 — й группы главной подгруппы
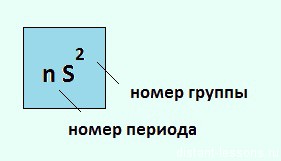
Элементы 2-й группы периодической системы имеют на внешнем энергетическом уровне 2 электрона, поэтому их валентность=2 , степень окисления — +2.
Внизу таблички есть подсказка: формула высшего оксида:
+2 -2
RO
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
Ну и если расписать строение подробно, например, для Ca, то вот «полный отчет»:
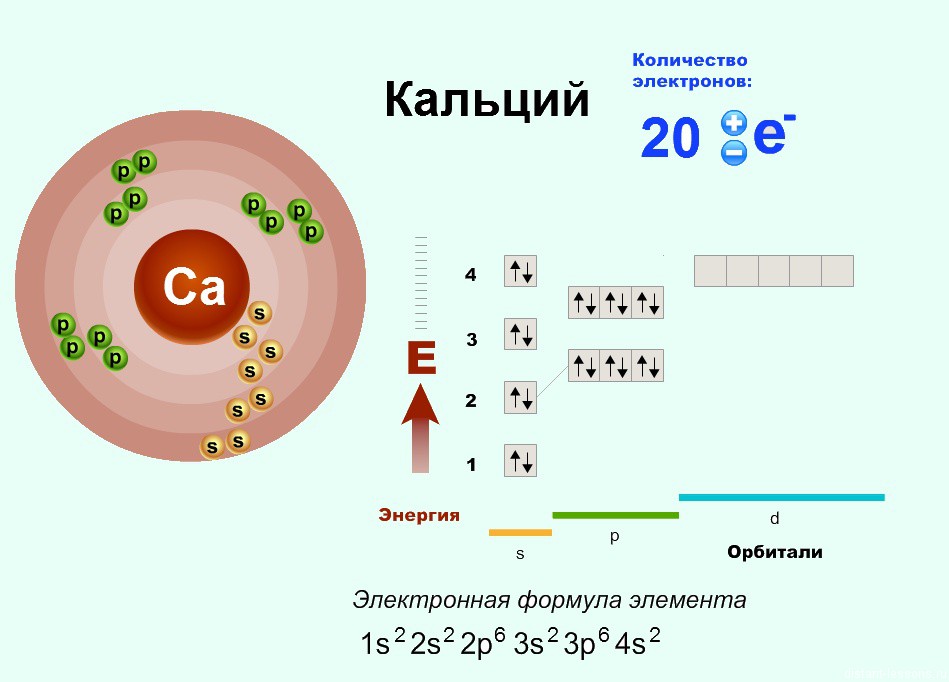
опечатка. В полном отчете вместо K R.
спасибо! исправили!