Свойства щелочных металлов
Свойства щелочных металлов
— Почему эти металлы называются «щелочными»?
— При растворении в воде они образуют щелочи.
— А что такое щелочи?
Пока вы не находитесь в лаборатории и не контактируете напрямую с разными веществами, то такие понятия очень абстрактны… Я сама осознала понятие «щелочь», когда на 1 курсе в лаборатории вытерла «мыльные» руки о синтетический халат и через 2 минуты обнаружила на этих местах дырки! 🙂
Щелочи – мылкие на ощупь, довольно едкие вещества. Они очень гигроскопичны (тянут на себя влагу). По воздействию на кожу они похожи на кислоты – так же разъедают и щипят (если концентрированные).
Но вернемся к металлам.
Для начала рассмотрим
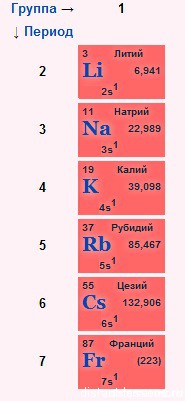
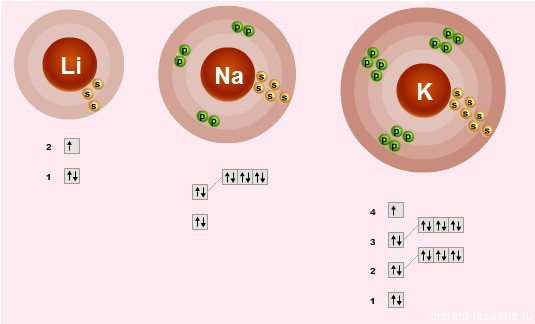
строение электронных оболочек
Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 1 неспаренный электрон на s-подуровне:
n S1
Что это означает?
- Валентности элементов = 1, т.е. каждый атом может образовывать 1 связь.
- Степень окисления элементов =+1 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, этот 1 электрон все слабее притягивается к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Fr более сильный металл, чем Li.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
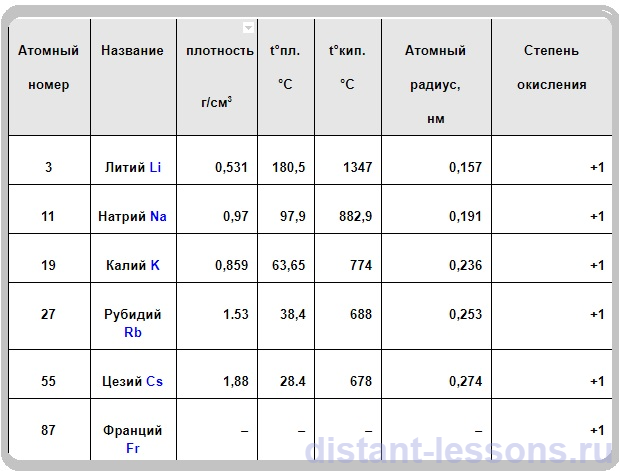
Физические свойства щелочных металлов
Общие характеристики:
- плотность Li, Na и K меньше 1 – они плавают по поверхности воды,
- т.к. все металлы очень активно реагируют с водой (гигроскопичны) – реагируют с большим выделением тепла – по сути, горят на воздухе, искрят, то их хранят под слоем вазелина.
- Все элементы окрашивают пламя в разный цвет:
Li — в-красный
Na – в жёлтый
K – в фиолетовый
Rb – в красно-коричневый
Cs – в красно-фиолетовый
- Электро- и теплопроводны
Химические свойства щелочных металлов
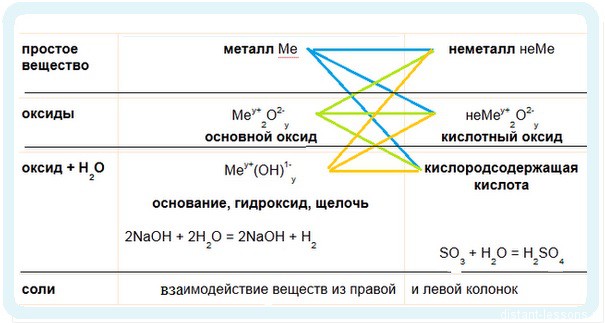
Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
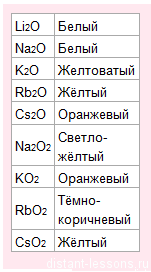
С кислородом образует оксиды, пероксиды и надпероксиды разных цветов:
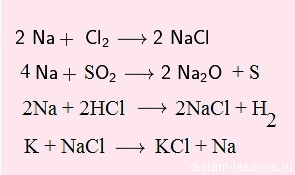
В реакциях с кислотами- окислителями водород не выделяется:
8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O
Обратите внимание на последнюю реакцию — взаимодействие металла с солью:
K + NaCl = Na + KCL
Не всякий металл может вступить в такую реакцию!
В таблице растворимости (она есть на развороте в любом учебнике по химии) внизу есть такая строчка:
Это электрохимический ряд активности металлов. Сейчас мы не будем подробно разбирать суть этого ряда, а просто примем за правило:
в этом ряду каждый предыдущий элемент может вытеснять последующий из его солей
2. Идем по зеленым стрелочкам — реакции для оксидов

3. Идем по оранжевым стрелочкам
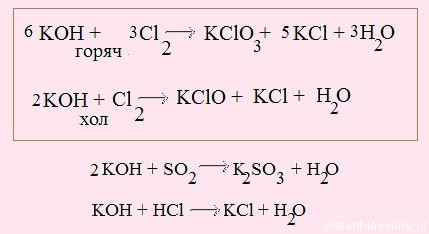
Обратите внимание на первые две реакции — они выделены в рамке. В первой реакции используется горячая щелочь — окисление идет до степени окисления хлора +5. При использовании холодной щелочи хлор окисляется только до +1.
Реакция щелочи с кислотой называется реакцией нейтрализации. Два сильных едких вещества нейтрализуют друг друга, образуя воду.
3. Отдельно надо выделить реакцию щелочных металлов с водородом.
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочными металлами будет проявлять отрицательную степень окисления. Получаются при этом гидриды:
Все соединения щелочных металлов хорошо растворимы в воде.
Это значит, что единственный способ их качественного определения — это цвет пламени и цвет оксидов. Никаких осадков их соединения не образуют.
style=»text-align: center;»>Получение металлов
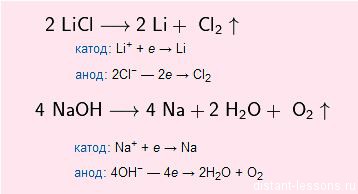
Обычно щелочные металлы получают электролизом расплавов их солей или щелочей:
NaCl (электролиз) → Na + Cl2
[TESTME 23]

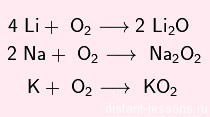

а как можно определять кислую среду, щелочную?
кислая среда — когда в реагентах H2SO4, HCl, кислота в общем,
щелочная — + NaOH, KOH
экспериментально среду определяют индикатором
спасибо!
Я думаю, что не маловажно сказать о взаимодействии щелочных оснований с амфотерными металлами, основаниями и солями. При избытке щёлочи/в растворе получается комплексная соль, а при недостатке/расплаве комплекса не будет.
Да, такая тема на сайте тоже есть