Периодическая система элементов
«Периодичка» — так чаще всего называют эту систему в школе — исследуем содержимое.
Периодическая система элементов
«…Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Это формулировка периодического закона, написанная самим Д.И.Менделеевым
современная формулировка периодического закона звучит так:
Свойства элементов, а также свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Итак…
1. Все элементы в системе расположены в порядке увеличения заряда ядра (=количеству протонов, следовательно, = количеству электронов)
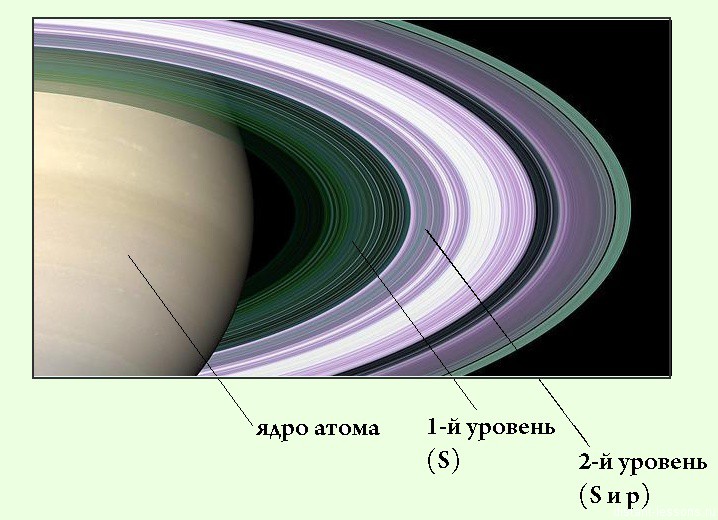
2. Горизонтальные ряды — это ПЕРИОДЫ. Их 7 штук — по числу энергетических уровней атома.
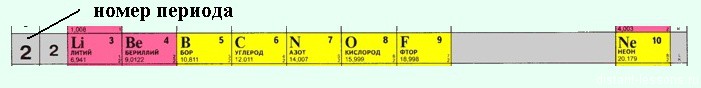
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Группы — вертикальные ряды — атомы располагаются по возрастанию заряда ядра, количества электронов, атомы одной группы имеют сходное электронное строение.
Номер группы соответствует количеству электронов на внешнем энергетическом уровне. В этом примере нам дана 6-я группа, значит, у всех элементов этой группы 6 электронов на внешнем уровне.
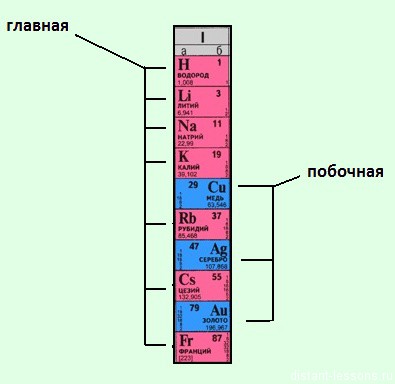
Группы подразделяются на подгруппы — главные (в столбце выровнены по левому краю), это подгруппы, содержащие s- и p- элементы, начинающиеся с элементов первого и второго периодов, и побочные (выровнены по правому краю), содержащие d-элементы.
Максимальное число электронов на энергетическом уровне — 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Максимальное число электронов на уровне:
S— 2 электрона
p— 6
d— 10
По аналогии с переходными элементами, число лантаноидов и актиноидов, вынесенных внизу Периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т.е. 14.
Теперь рассмотрим «содержимое» ячейки системы
- находится во 2-ом периоде, значит в атоме 2 энергетических уровня
- располагается в 5-ой группе, значит, на внешнем энергетическом уровне у него 5 электронов
Так по содержимому периодической системы можно проанализировать любой элемент:
|
Порядковый номер элемента |
Общее количество протонов и электронов |
| Число в нижней части ячейки |
Атомная масса |
| Номер периода | Количество энергетических уровней атома |
|
Номер группы |
Количество внешних, валентных электронов |
В периодической системе 114 химических элементов.
Условной границей, отделяющей металлы от неметаллов, служит прямая, проведенная от бора до астата
- в длиннопериодном варианте периодической таблицы элементы-металлы расположены в начале периодов, а также в побочных подгруппах.
- металлы оказываются левее и ниже этой прямой, неметаллы — правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, иногда их называют металлоидами, или амфотерными элементами




Здравствуйте.
Группа содержит подгруппы. А далее правая и левая сторона попутаны местами. может мы смотрим с разных сторон?..
! спасибо, что обратили внимание! Действительно, опечатка! Исправим!
здравствуйте!
у вас написано «Максимальное число электронов на энергетическом уровне — 8.» (ниже рисунка с 1ой группой) — что это значит?
Добрый день! У всех элементов, начиная со второго периода (кроме d-элементов) на внешнем энергетическом уровне максимально возможное кол-во электронов — 8
на s — орбитали максимально возможное кол-во электронов — 2
на p — 6. в сумме — 8 электронов
вот в таком виде эта фраза мне понятна :-).
А то я задумалась про d-элементы… почему, думаю, 8… может, электроны с d-уровня не считаются внешними… это я так загрузилась ))
а вообще — спасибо за сайт!
я рада, что стало понятнее и что сайт полезен! Заходите, буду вам рада! 🙂