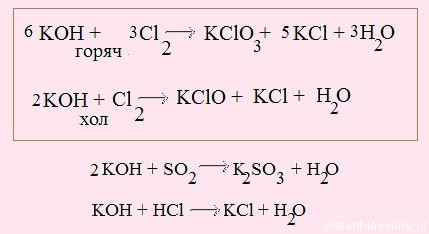Свойства оснований и кислот
Задание А10 ЕГЭ по химии —
Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот
Темы, которые нужно знать:
- Классификация неорганических соединений;
- Свойства азотной кислоты;
- Свойства серной кислоты;
- Щелочные металлы
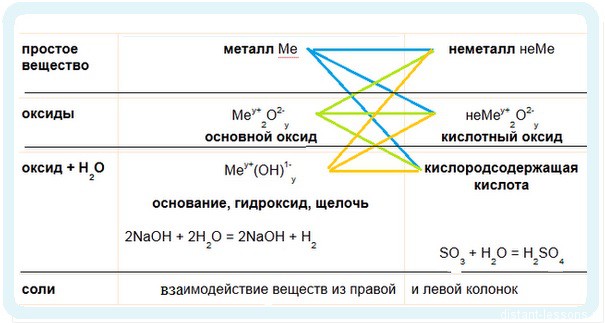
И опять определять основные химические свойства оснований и кислот мы будем по таблице:
Химические свойства оснований:
1. Взаимодействие с неметаллами (идем по желтым стрелочкам):
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение — взаимодействие щелочей с хлором:
Эту реакцию мы уже рассматривали много раз, например, в контексте свойств простых веществв.
2. Взаимодействие с кислотными оксидами с образованием солей:
2NaOH + SO2 = Na2SO3 + H2O
3. Взаимодействие с кислотами — реакция нейтрализации:
- с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли — избыток щелочи; - с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли — избыток кислоты; - с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли — избыток основания.
4. С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества:
2NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl
NaOH + NH4Cl = NaCl + NH4OH — малодисс.
Амфотерные гидроксиды:
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
Al(OH)3 + NaOH = Na[Al(OH)4]
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
1. Кислоты взаимодействуют с металлами с выделением водорода, если металл стоит в ряду напряжений до водорода H:
2Na + 2HCl =2 NaCl + H2
с металлами после водорода Н взаимодействуют только кислоты — окислители и уже без выделения водорода:
Cu +2 H2SO4 = CuSO4 + SO2 +2 H2O
Кислоты — окислители могут взаимодействовать и с неметаллами:
S +2H2SO4 = 3SO2 +2 H2O
Какие кислоты являются окислителями? Те, в которых элемент кислотного остатка проявляет высшую (или близкую к высшей) степень окисления (соответствует номеру группы элемента):
| Кислота — окислитель | Степень окисления элемента |
| H2SO4 | степень окисления серы S= +6 |
| HNO3 | степень окисления азота N= +5 |
| HClO4 | степень окисления хлора Cl= +7 |
| HMnO4 | степень окисления марганца Mn= +7 |
| H2Cr2O7 | степень окисления хрома Cr= +6 |
2. С основными и амфотерными оксидами и основаниями кислоты дают соли:
Na2O + 2HCl = 2NaCl + H2O
2Al(OH)3 +3 H2SO4 = Al2(SO4)3 + H2O
3. C солями кислоты реагируют, если образуется осадок, газ или малодиссоциирующее вещество:
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3 + H2SO4= Na2SO4 + CO2 ↑+ H2O
Свойства оснований и кислот определяются самыми простыми реакциями обмена и замещения, дополнительно — различные окислительно-восстановительные с участием кислот — окислителей.
Кстати, в нашем вопросе с гидроксидом калия:
1) Осадок. газ или малодиссоциирующее вещество не образуется — не подходит;
2) С гидроксидом алюминия реакция пойдет, а вот с нитратом серебра — нет;
3) С гидроксидом цинка реакция пойдет, с оксидом — нет, т.к. он основной;
4) 2KOH + ZnCl2 = Zn(OH)2 ↓+ 2KCl — выпадает осадок
6KOH + P2O5 (кислотный оксид) = 2K3PO4 + 3H2O
Ответ: 4)
[TESTME 38]