Типы химических реакций
Основные типы химических реакций

Каждый тип реакции — это отдельная большая тема, которую мы будем подробно разбирать отдельно. В этой статье мы просто пройдемся по основным типах химических реакций.
Для начала разберемся с некоторыми терминами.
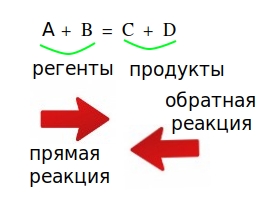
- Реагенты — вещество ( или одно вещество), вступившие в реакцию
- Продукты — вещества, получившиеся в результате реакции
- Прямая реакция — (условное понятие, только для записи уравнения) — та, что записана слева от «равно» или «стрелочки»
- Обратная — та, что записана справа от «равно»
Обратимые и необратимые
Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Условия необратимости реакции – образование осадка, газа или слабого электролита
Но на практике не все так просто как в определениях
Необратимая реакция — реакция, в которой реагенты превращаются в продукты реакции, но продукты не могут реагировать между собой и образовывать обратно реагенты.
Реакция идет только в одном направлении (прямом)
Примеры:
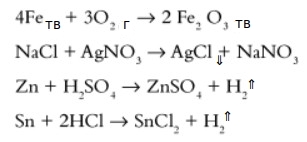
Обратите внимание — в уравнении ставится не знак равно (=), а стрелочка ( ->), указывающая направление процесса.
Обратимая — наоборот.
Примеры:
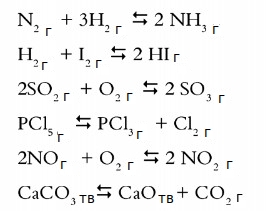
Здесь тоже не используется знак равно (=). Вместо него стрелки в обе стороны, показывающие, что возможно как прямое направление процесса, так и обратное.
Гомогенные и гетерогенные реакции
Гомогенная реакция — и реагенты, и продукты реакции находятся в одном агрегатном состоянии ( газы, жидкости или твердые вещества)
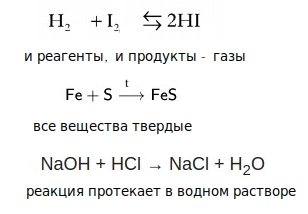
Гетерогенные реакции — и реагенты, и продукты могут находиться в разных агрегатных состояниях.
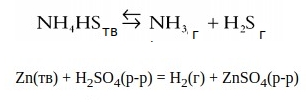
По количеству и составу реагентов и продуктов

Из схемы понятно, что:
Реакции соединения — два и больше реагента образуют один продукт
Реакции разложения — наоборот -из одного вещества получается два и больше продуктов
Реакции замещения — обычно простое вещество вступает в реакцию со сложным веществом, при этом образуется другое сложное вещество и выделяется другое простое вещество
атомы одного из элементов в сложном веществе заменены на атомы простого реагента
Реакции обмена — два сложных вещества обмениваются составляющими ( обычно это ионы) друг с другом.
Это реакции, в которых атомы элементов не меняют свои степени окисления

В органической химии реакции замещения отличаются по смыслу от неорганических реакций:
атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку)
Окислительно-восстановительные реакции
степени окисления атомов изменяются, так как между ними происходит обмен электронами
Кстати, к окислительно-восстановительным будут относиться реакции соединения и замещения , а так же некоторые разложения и замещения:
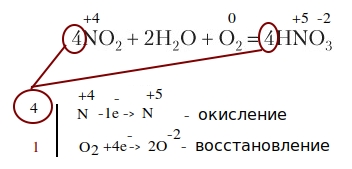

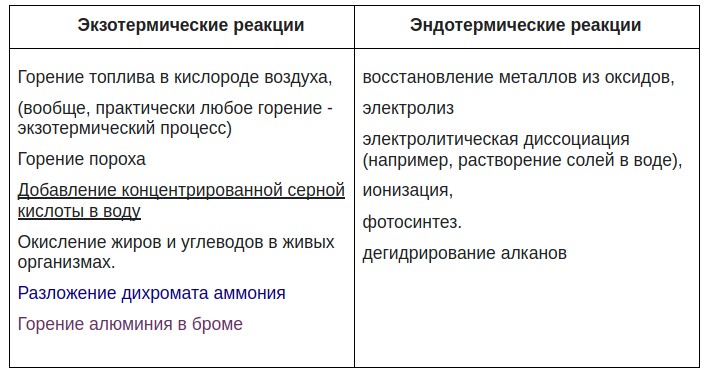
Реакции с тепловым эффектом
Эндотермические реакции — химические реакции, сопровождающиеся поглощением теплоты (-Q)
Чтобы легче было запомнить, попробуйте — перенесите Q в реагенты, получите:
N2 + O2 + Q -> 2NO
Получается, что тепловой эффект в реагентах — реакция идет с «затратой» теплоты
Экзотермические реакции — химические реакции, сопровождающиеся выделением теплоты (+Q)
Здесь теплота в продуктах — идет ее выделение
Встречаются в ЕГЭ вопросы, когда тепловой эффект не указан, а тип реакции определить нужно:
Дополнительно еще можно указать реакции, которые не идут самостоятельно, а только при дополнительном воздействии — это каталитические — катализатор нужен, не вступая в химическое взаимодействие, поменять скорость реакции, и электролитические ( смотрите отдельные большие темы — электролиз растворов и электролиз расплавов)
- тест ЕГЭ по типам химических реакций