Изменение скорости реакции
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Тема большая, зачастую в ней присутствуют формулы для расчета скорости, но в этой статье мы разберем все вопросы в формате подготовки к ЕГЭ.
Факторы, влияющие на
изменение скорости реакции
- концентрация;
- площадь поверхности реагентов;
- катализатор реакции;
- давление;
- температура
Теперь разберем каждый фактор отдельно.
1. Влияние концентрации на изменение скорости реакции:
По указанному определению можно записать формулу скорости:
ν — скорость реакции
ΔС — изменение концентрации
Δt — время реакции
Если Δt — примем как постоянную, не меняющуюся величину, то изменение скорости реакции напрямую зависит от изменения концентрации
| Изменение скорости реакции прямопропорционально изменению концентрации |
Эта зависимость определяется не только уравнением. Есть простая логика — чем больше вещества, тем больше взаимодействие между частицами — тем быстрее идет реакция.
2. Влияние площади поверхности на изменение скорости реакции.
Есть гетерогенные реакции — реакции, в которых есть больше чем одна фаза:
— твердое вещество \ жидкость: Zn + 2HCl = ZnCl2 + H2
— твердое вещество \ газ: C + O2= CO2
| Изменение скорости реакции прямопропорционально площади поверхности |
Давайте представим, что кусочек цинка бросили в кислоту. Что будет происходить? Слой за слоем металл будет растворяться.
А что будет если мы внесем в кислоту цинк в виде порошка? Конечно, реакция пройдет намного быстрее.
Есть, конечно, определенные нюансы, но в школьном курсе они не рассматриваются…
3. Влияние температуры на изменение скорости реакции.
Как и в случае концентрации, увеличение температуры увеличивает количество активных столкновений между частицами, что, естественно, увеличивает скорость реакции.
Изменение скорости реакции при повышении температуры соответствует правилу (приблизительному, для точных определений существует ряд формул) —
|
4. Влияние катализатора на изменение скорости реакции.
Здесь все очень просто. Определение катализа и катализатора говорит само за себя:
катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции.
5. Влияние давления на изменение скорости реакции.
А вот на этот пункт стоит обратить внимание.
Давление влияет на изменение скорости реакции именно в газовой среде.
Любой газ занимает весь предоставленный объем — молекулы разлетаются, и число их столкновений уменьшается. Если повысить давление, число активных соударений возрастает, соответственно, скорость реакции увеличивается.
|
Изменение скорости реакции в газовой фазе прямопропорционально изменению давления |
- в ЕГЭ это вопрос А20 — Скорость реакции, ее зависимость от различных факторов

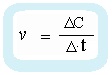



Доброго дня. помогите с решением:
SO2+2O=2SO3
во ск раз изменится скорость реакции, если
а) уменьшение объема системы в 2 раза,
б) повышение концентрации кислорода в 4 раза.
Заранее благодарю
у вас уравнение неверно записано. Должно быть: 2SO2 + O2 = 2SO3
v = k* C^2(SO2) *C(O2)
концентрация = моль\л, т.е. на объем
из-за уменьшения объема концентрация увеличится в 2 раза: v=k*2C^2(SO2)*2C(O2)? т.е. в 8 раз ув-ся скорость
Если увеличиваем в 4 раза концентрацию кислорода, то и скорость возрастет в 4 раза
Здравствуйте.Помогите пожалуйста:
Хлорирование бензола до хлорбензола в дихлорэтане или тетрахлористом углероде протекает значительно медленнее, чем в уксусной кислоте.Дайте этому объяснение