Подгруппа азота
5-я группа главная подгруппа —
подгруппа азота
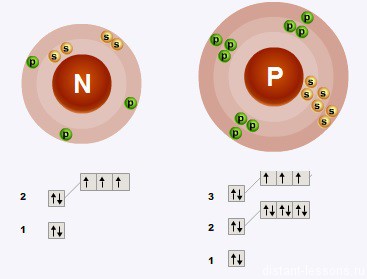
Общая конфигурация внешнего электронного слоя:
nS2 np3
Что это означает?
- Валентность азота и валентность фосфора равна 5 и 3, т.е. каждый атом может образовывать 5 связей или 3 связи.
- Степень окисления азота = +5, +3, -3 — основные (+2, +1 — дополнительные),
степень окисления фосфора: +5, +3, -3 - Сверху вниз в подгруппе радиус атома увеличивается, следовательно, эти электроны все слабее притягивается к ядру атома, следовательно, сверху вниз металлические свойства элементов подгруппы азота увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства, окислительные уменьшаются.
В формате подготовки к ЕГЭ мы рассмотрим свойства двух элементов подгруппы азота — N и P.
Физические свойства
- физические свойства азота — газ без цвета и запаха — N2. Нерастворим в воде.
- физические свойства фосфора — имеет довольно много аллотропных модификаций. Нерастворим в воде. Как неметалл, не проводит электрический ток, нетеплопроводен.
Химические свойства азота
(химические свойства фосфора)
| Восстановительные свойства |
Окислительные свойства |
N и P будут проявлять восстановительные свойства по отношению к тем элементам, которые стоят правее них в периодической системе.
|
N и P могут проявлять окислительные свойства с элементами левее и ниже их в периодической системе:
|
Кислородсодержащие соединения азота и фософора
|
Оксиды фосфора P2O3 — оксид фосфора (III) P2O5 — оксид фосфора (IV)
P2O3 + 3H2O = 2H3PO3 — фосфористая кислота P2O5 + 3H2O = 2H3PO4 —фосфорная кислота (средней силы) 2P + 3H2 = 2PH3 — — фосфин — очень характерный запах |
Оксиды азота
оксид азота(I) N2O — закись азота, веселящий газ; несолеобразующий оксид оксид азота(II) NO (монооксид азота); несолеобразующий оксид оксид азота(III) N2O3, азотистая кислота, производные аниона NO2−; кислотный оксид оксид азота(IV) NO2 (диоксид азота, бурый газ);несолеобразующий оксид оксид азота(V) N2O5, азотная кислота, её соли — нитраты и другие производные, кислотный оксид. N2O3 + H2O = 2HNO2 — азотистая кислота (слабая кислота) |
[TESTME 30]

Здравствуйте, Лолита. Вопрос по степени окисления азота. Вы пишите о дополнительных степенях окисления +1 и +2. Какая степень окисления азота в соединении NO2?
Добрый день!
В NO2 у азота +4
Здравствуйте Лолита Витальевна! Объясните пожалуйста, почему азот может проявлять степени окисления +4 и +5? Ведь у него нет дополнительного подуровня для распаривания двух s-электронов. Разве спаренные электроны могут образовывать связи? А вот фосфор (согласно Википедии) не может проявлять степени окисления -2 и +2. Почему? Ведь у него три неспаренных электрона, разве он не может присоединить еще два или отдать два?
+5 — думаю, понятно почему — азот отдал все электроны — и с s-подуровня, и с p-подуровня.
Другие степени окисления азота (+1, +4, +2) — это условность. На самом деле молекулы устроены немного не так. как пишем в формулах — там образуется донорно-акцепторная связь, записи молекул NO2, NO и N2O — упрощенные
То есть получается, например, в молекуле NO2 одна связь образована по донорно-акцепторному механизму за счёт двух s-электронов, вторая — обычным способом, и ещё остается один неспаренный электрон?
Понятно, спасибо!
Ольга, вам осталось 2 тематических комментария до получения подарка от сайта! 🙂
При обычных условиях фосфор с водородом не взаимодействует или я чего-то не понимаю?
С водородом фосфор практически не соединяется