Электролиз водных растворов солей
Электролиз водных растворов солей
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
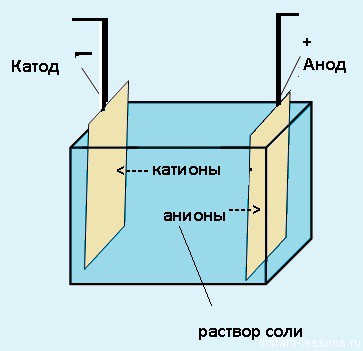
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
Для этого нам понадобится ряд активности металлов \ электрохимический ряд напряжений:
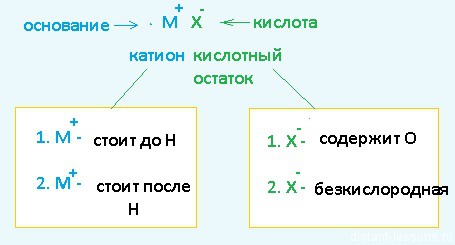
Разберем сначала катионы:
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH– Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu2+ + 2е = Cu0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН—Zn2+ + 2e = Zn0
Теперь анионы-кислотные остатки:
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl− — 1e = Cl20 Хлор выделяется на аноде - Исключение: F− — вместо него будет выделяться кислород.
Примеры:
1.1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
K2SO4↔2K++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
2H2O (электролиз) → 2H2 + O2
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
LiCl ↔ Li+ + Cl−
катод (-): 2H2O + 2e = H2 + 2OH−
анод (+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
2LiCl + 2H2O(электролиз) → H2 + Cl2 +2LiOH
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н+
2CuSO4 + 2H2O(электролиз) → 2Cu + 2H2SO4 + O2
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu2+ + 2e = Cu0
анод (+): 2Cl− — 2e = 2Cl0
CuCl2 (электролиз) →Cu + Cl2
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
[TESTME 56]


Здравствуйте. Очень благодарна вам за такое понятное объяснение темы.
У меня к Вам вопрос. В одном из заданий В3, где нужно было определить продукт на катоде, я столкнулась с такой проблемой. В одной из формул веществ был написан AlCl3. Продуктом на катоде я написала водород. Но в ответ к заданию был алюминий. Скажите в чём моя ошибка или это ошибка в тесте?
Водород — правильный ответ. В ответах к тренировочным тестам ЕГЭ очень часто бывают ошибки. Да и не только в ответах. В этом году, например, в заданиях пробных ЕГЭ быди ошибки!
1. Запишите все возможные процессы на аноде, установите потенциалы процессов.
2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь?
3. Выясните, меняется ли среда около анода, если да, то как и почему?
4. Запишите все возможные процессы на катоде, установите потенциалы процессов.
5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь.
6. Установите, меняется ли среда около катода, если да, то как и почему?
7. Запишите итоговую схему процесса электролиза.
0,1 M раствор CuSO4
pH = 5, катод – Al, анод – Сu
здесь решают задачи школьного уровня. Не сможем вам помочь
Спасибо большое за это объяснение, но всё же не совсем понятно. Что делать со среднеактивными металами такими как Mn,Zn, Cr … Pb.
ZnCl2 ↔ Zn2+ + 2Cl−
K»катод»(-): Zn2+ + 2e = Zn0
A»анод»(+): 2Cl− — 2e = 2Cl
Разве здесь не так?
Заранее спасибо.
Надо различать электролиз расплавов и электролиз растворов солей.
В случае электролиза расплава соли ZnCl2 на катоде выделится Zn, на аноде — Cl2.
Если мы рассмотрим электролиз растовра ZnCl2, то вместо Zn на катоде будет выделяться водород, на аноде будет Cl2:
ZnCl2 + 2H2O (электролиз)-> Zn(OH)2 + H2 + Cl2
Я снова здесь. первый вопрос такой — электролиз раствора NaOH
K(-)2H2O +2e = H2 + 2OH(-)
A(+)4OH(-) -4e = O2 + 2H2O общее уравнение как будет выглядеть?
NaOH (р-р) + 2H2O= (электролиз) = 2H2 + O2 + NaOH, т.е. по сути электролизу подвергается вода 🙂
Или все-таки натрий должен восстанавливаться на катоде?
В водном растворе натрий не будет на катоде. только при электролизе расплава
сама себя спрашиваю, сама себе отвечаю))) Натрий восстанавливается если в расплаве. Здесь наверное общее уравнение электролиза это разложение воды током. 2H2O = 2H2 + O2
Да, все верно 🙂
а если смесь NaOH и KCl? Уравнение гидролиза растворов щелочи и KCl (2KCl + 2H2O = 2KOH + H2 + Cl2) как объединить?
Гидролиза? или электролиза?
ну конечно электролиза, ошиблась. Лолита Витальевна и раз Вы тут. Подскажите мне про смесь расплавов NaF и KCl. Общее уравнение электролиза будет так выглядеть? 2 NaF + 2KCL = 2Na + 2 K + F2 + Cl2 ? Вопрос вот в чем, дано соответствие — А) смесь NaF и KCl и под №3 — продукты электролиза правильный ответ — Na и Cl2. Объясните почему именно они.
да, все правильно, 2 NaF + 2KCL = 2Na + 2 K + F2 + Cl2, а в ответах бывает самое разное… но этот вариант вроде подходит… а какие еще даны ответы?
Просто в вариантах ЕГЭ в ответах на тему электролиза не пишут все продукты реакции, могут написать, например, продукт реакции — H2… понятно, что там не только водород, но так пишут….
1) Mg, F2
2)H2, O2
3)Na,Cl2
4)H2, Cl2
5)Mg, Cl2
6)Na, F2
Вот шестой вариант вроде тоже подходит, а почему правильный третий ?
вопрос про электролиз расплавов? 2 NaF + 2KCL = 2Na + 2 K + F2 + Cl2
тогда да, оба ответа -и 3 и 6 подходят… в ответах, кстати, очень часто встречаются ошибки.
Если раствора, то 4) подойдет
Ну и тут как будет выглядеть общее уравнение электролиза?
NaOH + 2H2O = электролиз= NaOH + 2H2 + O2
2Kcl + 2H2O = = электролиз= 2KOH + H2 + cl2
____________________________________________
NaOH + 2KCl + 4H2O = NaOH + 2KOH + 3H2 + O2 + Cl2
Проверьте, пожалуйста, правильно ли составила уравнения электролиза раствора HClO4?
HClO4 —>H(+) + ClO4(-)
K(-) 2H(+) +2e = H2 |2
A(+) 2H2O — 4e = O2 + 4H(+) |1
________________________
2HClO4 + 2H2O = 2H2 + O2 + 2HClO4
все верно
Еще такой электролиз р-ра: Pb(NO3)2 —> Pb(+2) + 2NO3(-)
K(-) Pb(+2) +2e = Pb(0)
2H2O + 2e = H2 + 2OH(-)
A(+) 2H2O — 4e = O2 + 4H(+)
_____________________
Pb(NO3)2 + 2H2O = Pb + H2 + O2 + 2HNO3
Гидроксид свинца потеряли: 2Pb(NO3)2 + 4H2O = Pb +Pb(OH)2 + 2H2 + O2 + 4HNO3
И последний вопрос на сегодня. Как будет выглядеть итоговое уравнение электролиза раствора KF? KF + 2H2O = H2 + O2 + ?(KF?)
2KF + 2H2O = электролиз = 2KOH + H2 + F2
Спасибо огромное!!!
ой, простите, а в растворе KF на аноде разве не вода будет окисляться? это же фторид. и тогда ещё будет +HF? или не?
Еще раз в лекции посмотрите — бескислородные анионы на аноде сами окисляются. До простых веществ. А вот вместо кислородсодержащих — кислород
2KF + 2H2O = электролиз = 2KOH + H2 + F2
В учебнике Габриеляна за 11 класс написано: анионы кислородсодержащих кислот и фторидов
(SO42-, NO3- , SO32- , CO32-, PO43-, F-) не окисляются, идёт процесс окисления молекул Н2О до O2:
2 Н2О — 4 ė → О2 + 4Н+
Разве нет?
Да, но в курсе ЕГЭ считается, что F- относится к бескислородным анионам, поэтому вместо него — вода
То есть то, что написано в учебниках — это не правильно? Или как это понимать? Значит, если попадется такой электролиз фторида в ЕГЭ, правильно будет не как учат в школе, а как неправильно? Вот тебе, бабушка, и Юрьев день, дожили….
Даже не знаю, что Вам ответить… могу сказать только одно — если в ЕГЭ попадется задание на электролиз фторида, пишите на электроде фтор, все остальное, так сказать, издержки нынешней учебной системы…
Вообще, в разных учебниках написано по-разному. На практике фтор не выделяется, выделяется кислород, может, не знаю, почему в ЕГЭ так…
У фтора самая высокая электроотрицательность, выше кислорода
Не будет он окисляться НИКОГДА из водных растворов
Да, абсолютно верно
Лолита, здравствуйте! У меня снова к вам вопрос! Вы пишите про катионы и отношении их к электролизу, делите их на три группы. Вы пишите, что в первой группе до водорода включительно восстанавливается вода, но ведь там лишь до АЛЮМИНИЯ включительно! Спасибо, жду отзыва!!!
Да, большое спасибо, что обратили внимание — надо внести поправку и на катионы и на фтор
И еще: не все бескислородные остатки на аноде окисляются до простых веществ, например, фтор!
через раствор CuCl2 пропустили ток 2А в течении 20 минут. Какое вещество и в каком количестве выделится на катоде? напишите уравнение реакций на инертных электродах
Ну, тут все по схеме, ничего нового:
на катоде выделится медь, на аноде — молекулярный хлор
Эти реакции есть в статье. Формула не из школьного курса, но есть в Википедии — это точно. Смотрите закон Фарадея
При электролизе смеси водных растворов солей на катоде последним выделится 1)Co
2)Zn
3)Cu
4)Hg
5)Nа
Надо смотреть по потенциалам восстановления — на какой элемент понадобится больше всего энергии…
При электролизе нитрата калия получили при н.у. водород объемом 44,8 л. Написать уравнения реакций, протекающих на нерастворимых аноде и катоде и расчитать, сколько времени протекал электролиз, если ток был 100 А.
2KNO3 + 4H2O -> 2KOH + 2H2 + 2HNO3 + O2
2H2O +2e(-)-> 2OH(-) + H2
2H2O -4e(-)-> O2 + 4H(+)
n(H2)=V\22.4
а дальше подставить в формулу закона Фарадея
11. При электролизе водного раствора Na2СО3 при пропускании тока силой 1,5 А на аноде выделилось 5,6 л кислорода (н.у.). Определите продолжительность процесса в минутах. Составьте схему процессов, происходящих на инертных электродах при электролизе данной соли.
Na2CO3 + 4H2O -> (электролиз)-> 2NaOH + H2CO3 + 2H2 + O2 — вот само уравнение.
А формула ваша — закон Фарадея — Законы Фарадея можно записать в виде следующей формулы:
m { Q \ F }{ M \ z }
где:
m — масса осаждённого на электроде вещества в граммах
Q — полный электрический заряд, прошедший через вещество
F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея
M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль)
z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.
помогите пожалуйста.
Одинаковы ли будут продукты, выделяющиеся на электродах при
электролизе водных растворов:
а) K2CO3 и Na2SO4;
б) NaCl и CuCl2;
в) Ba(NO3)2 и Pb(NO3)2
а) катионы этих солей стоят до водорода в электрохимичесом ряду, анионы — кислородсодержащие
Помогите пожалуйста!Какие вещества образуются при электролизе с угольными электродами водных растворов FeCl3 в щелочной среде и K2CO3 в щелочной среде.
FeCl3 — на катоде водород и железо, в растворе Fe(OH)3, на аноде — Cl2
K2CO3 — на катоде водород, на аноде — кислород, в растворе KOH, выделяется CO2
Спасибо большое
успехов! 🙂
Здравствуйте! Где можно найти информацию (шк.уровня), которая дает объяснение почему кислородсодержащие анионы не разряжаются на аноде. Или школьников отправлять к таблицам электродных потенциалов? Спасибо!
По потенциалам. В этом же вся суть вопроса
Помогите написать уравнение электродных процессов, протекающих при электролизе водного раствора NaNo3 с инертными электродами
Добрый день!
Все как в уроке:
2NaNO3 + 4H2O -> электролиз -> 2H2 + 2HNO3 + 2NaOH + O2
Лолита, здравствуйте! Я-врач-биохимик, глубоко на пенсии, имею стаж препода. Готовя внука к ЕГЭ. роюсь в инете, наткнулась на ваш сайт. Слов нет: вы — НАСТОЯЩИЙ УЧИТЕЛЬ!!! Сами постоянно учитесь, признаёте свои ошибки, легко с ними справляетесь и чужие ошибки вас не загоняют в тупик — да! нынче менеджеры от образования учат умению не дать себя запугать — столько ошибок во всех пособиях… За электролиз — отдельное спасибо. Но мне кажется, следует подчеркнуть, что при электролизе р-ров солей Ме, стоящих после Al до водорода, выделяется и водород и Ме. С огромным почтением и признательностью.
Огромное спасибо за добрый отзыв! Очень приятно!
Статью по электролизу буду переделывать, вообще, каждый год стараюсь подгонять статьи под новый уровень ЕГЭ, с каждым годом сложностей в них все больше
Здравствуйте, пожалуйста, помогите с задачей!
При электролизе водного раствора соли газы на катоде и аноде не выделялись. Какая соль могла быть взята?
Чтобы не выделялся водород на катоде, металл должен стоять в ряду напряжений после H — Cu, Ag, Hg….
чобы на аноде не было кислорода, анион соли должен быть бескислородным, ну и чтобы сам в виде газа не выделялся. Подходит сульфид.
ПОлучаем, что соль — судбфид металла, стоящего в ряду напряжений после Н
Подскажите, а как происходит электролиз воды? Она же слабый электролит
2H2O -> электролиз -> 2H2 + O2
Электролиз воды, также известный как электрохимическое расщепление воды, представляет собой процесс использования электричества для разложения воды на кислород и газообразный водород