Свойства молекулы воды
Размышления ( не учебный материал !!!) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
Общие
свойства молекулы воды
-
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
-
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
-
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
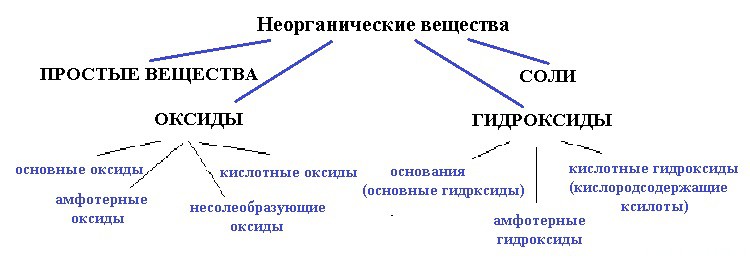
Ниже приведена схема:
-
вода — точно не простое вещество, так как образована атомами разных элементов;
-
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
-
Взаимодействие с кислотами.
-
Взаимодействие с кислотными оксидами.
-
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
-
Взаимодействие со щелочами.
-
Взаимодействие основными оксидами.
-
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу: реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H+ и анион OH—.
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
-
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
-
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
-
Взаимодействие с амфотерными гидроксидами.
-
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
-
Реакции с металлами.
-
Реакции с основными и амфотерными оксидами.
-
Реакции с основаниями и амфотерными гидроксидам.
-
Реакции с солями.
-
Для сильных кислот так же реакции ионного обмена.
-
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
Разберем подробно.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Al2S3 + HOH → Al(OH)3↓ + H2S↑
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H+ и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Al2S3 + HOH → Al(OH)3↓ + H2S↑
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Подведем итог.
Сформулируем основные положения теории «Вода — кислота»:
-
Молекула воды по свойствам — слабая (очень слабая) кислота.
-
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
-
Вода как кислота образует соли — гидроксаты.
-
К гидроксатам относятся амфотерные и основные гидроксиды.
-
Формула воды: HOH.
-
Правильные названия воды: гидроксид водорода, гидроксильная кислота.