Гибридизация атомных орбиталей
В органической ( и неорганической химии мы часто встречаем понятие
Гибридизация атомных орбиталей
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Обратите внимание на слово «гипотетический» — это значит предположительный, т.е. так химики попытались объяснить явление, когда атом образует большее количество связей, чем он может образовать в основном (невозбужденном) состоянии, когда есть определенное неспаренное число электронов.
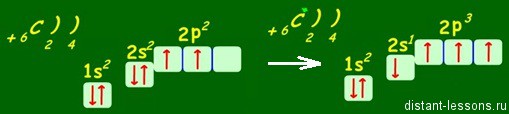
Например, возбужденное состояние атома углерода — основа органической химии:
Гибридизация атомных орбиталей происходит когда образуется ковалентная связь, и образуется она тогда, когда это энергетически более выгодно.
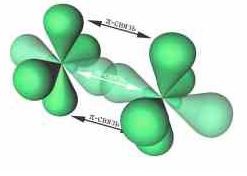
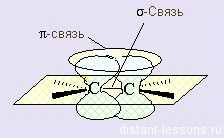
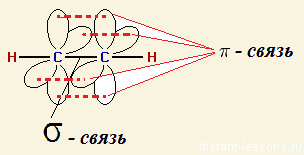
1 пример: смешение s- и двух p-орбиталей (2 другие остаются негибридными): Sp-гибридизация атомных орбиталей: молекула будет иметь линейную форму (180o) (у алкинов)
Примеры неорганических соединений: BeF2 (F-B-F) , CO2 (O=C=O), NO2+ (O=N+=O)
2 пример: смешение s- и трех p-орбиталей (одна p-орбиталь останется негибридной) : Sp2-гибридизация атомных орбиталей: молекула будет иметь треугольную форму (120o) (у алкенов)
Примеры неорганических соединений: BF3, ион NO3—, ион CO32-
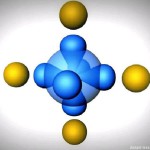
3 пример: смешение s- и четырех p-орбиталей: Sp3-гибридизация атомных орбиталей: молекула будет иметь тетраэдрическую форму (109,5o) (у алканов)
Примеры неорганических соединений: CH4, ион ClO4—, ион SO42-, ион NH4+
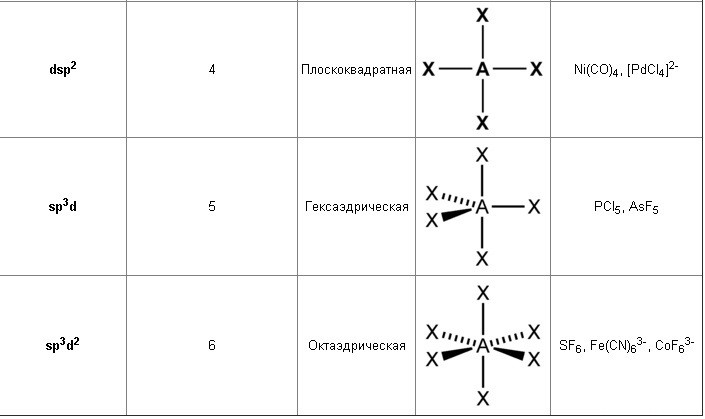
Возможна гибридизация атомных орбиталей, затрагивающая и d-орбиталь:
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
- находят центральный атом и определяют число σ-связей (по числу концевых атомов);
- определяют степени окисления атомов в частице;
- составляют электронную конфигурацию центрального атома в нужной степени окисления;
- если это необходимо, проделывают то же самое для концевых атомов;
- изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально спаривают электроны;
- отмечают орбитали, участвующие в образовании связей с концевыми атомами;
- определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
- по типу гибридизации определяют геометрию химической частицы.