Пробный ЕГЭ 2013 часть С
До экзамена по химии осталось примерно 4 месяца, так что пора пробовать свои силы — решаем свежие варианты по химии:
пробный ЕГЭ 2013 часть С
До экзамена по химии осталось примерно 4 месяца, так что пора пробовать свои силы — решаем свежие варианты по химии:
d-элементы образуют очень разнообразные соединения самых разных цветов. Переход от низшей степени окисления к высшей меняет свойства соединений от основных к кислотным.
Давайте разберем задачи на d-элементы.

Хлор — самый богатый на кислоты элемент!
5 кислот — таким рекордом может похвастаться не каждый!
Селен — элемент подгруппы кислорода — один из халькогенов. В школьном курсе химии селен практически не рассматривают… Однако в последнее время все чаще всплывает вопрос его биологической роли.
Окислительно-восстановительные реакции (овр) — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Когда я начинаю занятия по химии и рассказываю о Периодической системе элементов, то всегда говорю, что это как ключ от всех дверей. В ней можно найти ответ на практически любой вопрос по химии.
Таблица растворимости тоже в этом плане очень информативна. Здесь можно найти не только соли и узнать растворимы они или нет. Здесь есть еще один маленький секрет, который может оказаться очень полезным…
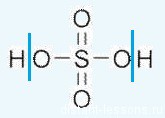
Формула серной кислоты — H2SO4
 Очень сильная кислота, к тому же это кислота-окислительь.
Очень сильная кислота, к тому же это кислота-окислительь.
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
Серная кислота и вода

C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
Переход средняя соль —-> кислая соль:
Na2SO4 + H2SO4 = 2NaHSO4
Переход кислая соль —->средняя соль:
2NaHSO4 = (t) = Na2SO4 + H2SO4
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
4HNO3 = 4NO2 + 2H2O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.